题目内容
20.化学与社会、生产、生活密切相关.下列说法正确的是( )| A. | 苯酚遇石蕊显红色 | B. | 食用花生油能发生水解反应 | ||
| C. | 包装用材料聚氯乙烯属于烃 | D. | PX项目中的对二甲苯属于饱和烃 |
分析 A、苯酚的酸性极弱;
B、食用花生油属于酯类;
C、烃是只含碳氢两种元素的化合物;
D、苯环中的键是介于单双键之间的特殊的键.
解答 解:A、苯酚的酸性极弱,不能使石蕊变红,故A错误;
B、食用花生油属于酯类,故在酸性或碱性条件下能发生水解,故B正确;
C、烃是只含碳氢两种元素的化合物,而聚氯乙烯塑料中含氯元素,故不属于烃,故C错误;
D、苯环中的键是介于单双键之间的特殊的键,是不饱和结构,故对二甲苯是不饱和烃,故D错误.
故选B.
点评 本题考查了常见有机物的性质,应注意的是苯酚的酸性弱于碳酸,极弱,不能使指示剂变色.

练习册系列答案
相关题目
11.硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如图:
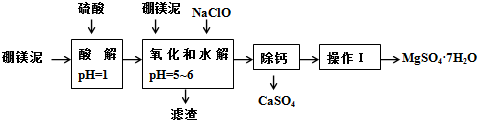
已知:某些氢氧化物沉淀的pH如表所示:
根据题意回答第(1)~(6)题:
(1)在酸解过程中,欲加快酸解时的化学反应速率,请提出两种可行的措施:适当升温、把硼镁泥粉碎、或搅拌、或适当增加硫酸浓度.
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O═MnO2↓+2H++Cl-,还有一种离子也会被NaClO氧化,并发生水解,该反应的离子方程式为2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+.
(3)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有SiO2、CaSO4.
(4)已知MgSO4、CaSO4的溶解度如表:
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤是蒸发浓缩,趁热过滤.“操作I”是将滤液继续蒸发浓缩,冷却结晶,过滤洗涤,便得到了MgSO4•7H2O.
(5)实验中提供的硼镁泥共100g,得到的MgSO4•7H2O为172.2g,计算MgSO4•7H2O的产率为70.0%.(保留两位有效数字)
(6)金属镁可用于自然水体中铁件的电化学防腐,完成如图防腐示意图,并作相应标注.

已知:某些氢氧化物沉淀的pH如表所示:
| 氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Mg(OH)2 | 9.3 | 10.8 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.7 | 4.7 |
(1)在酸解过程中,欲加快酸解时的化学反应速率,请提出两种可行的措施:适当升温、把硼镁泥粉碎、或搅拌、或适当增加硫酸浓度.
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O═MnO2↓+2H++Cl-,还有一种离子也会被NaClO氧化,并发生水解,该反应的离子方程式为2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+.
(3)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有SiO2、CaSO4.
(4)已知MgSO4、CaSO4的溶解度如表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(5)实验中提供的硼镁泥共100g,得到的MgSO4•7H2O为172.2g,计算MgSO4•7H2O的产率为70.0%.(保留两位有效数字)
(6)金属镁可用于自然水体中铁件的电化学防腐,完成如图防腐示意图,并作相应标注.

8.下列实验操作中错误的是( )
| A. |  倾倒液体 | B. |  检查装置的气密性 | ||
| C. |  移走加热的蒸发皿 | D. |  加热液体 |
12.下列离子方程式书写正确的是( )
| A. | 金属铝投入NaOH溶液中:2Al+2OH-+H2O═2AlO2-+2H2↑ | |
| B. | 石英与烧碱反应:SiO2+2OH-═SiO32-+H2O | |
| C. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 向小苏打溶液中加入过量Ba(OH)2:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- |
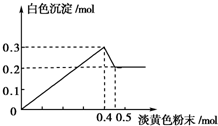 有一透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入一种淡黄色粉末固体时,加热有刺激性气味的混合气体放出,同时生成白色沉淀.当加入0.4mol淡黄色粉末时,产生气体0.3mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,且加入淡黄色粉末时产生白色沉淀的量如如图所示.(已知:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O).
有一透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入一种淡黄色粉末固体时,加热有刺激性气味的混合气体放出,同时生成白色沉淀.当加入0.4mol淡黄色粉末时,产生气体0.3mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,且加入淡黄色粉末时产生白色沉淀的量如如图所示.(已知:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O).