题目内容
9.有含钠元素的两种化合物A和B,它们与化合物F的反应分别是A+F→C+D↑ B+F→C+E↑又知D和E两种气体以个数比1:2化合成为液态化合物F.经分析知A含有D中的非金属元素,B为金属钠与E元素化合成的相对分子质量为24的固体.(1)写出化学式:ANa2O2 BNaH DO2 EH2 FH2O
(2)写出的A+F→离子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑ B+F→的化学方程式NaH+H2O=NaOH+H2↑
(3)A中阴阳粒子个数比为:1:2.
分析 D和E两种气体以个数比1:2化合成为液态化合物F,则液态化合物F为H2O,D为O2,E为H2,B为金属钠与E元素化合成的相对分子质量为24的固体,可知B为NaH,根据反应A+F→C+D↑ B+F→C+E↑,进一步可推知A为Na2O2,C为NaOH,以此解答该题.
解答 解:D和E两种气体以个数比1:2化合成为液态化合物F,则液态化合物F为H2O,D为O2,E为H2,B为金属钠与E元素化合成的相对分子质量为24的固体,可知B为NaH,根据反应A+F→C+D↑ B+F→C+E↑,进一步可推知A为Na2O2,C为NaOH,
(1)由以上分析可知A:Na2O2 B:NaH D:O2 E:H2 F:H2O,
故答案为:Na2O2;NaH;O2;H2;H2O;
(2)Na2O2和H2O反应生成NaOH和O2,反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑,NaH和H2O反应生成NaOH和H2,反应的化学方程式为NaH+H2O=NaOH+H2↑,
故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑;NaH+H2O=NaOH+H2↑;
(3)A为Na2O2,Na2O2中阴阳粒子个数比为1:2,
故答案 为:1:2.
点评 本题考查无机物的推断,题目难度中等,解答本题的关键是液态化合物F,注意B的推断,为易错点,注意把握物质的组成和性质的应用.

练习册系列答案
相关题目
20.化学与社会、生产、生活密切相关.下列说法正确的是( )
| A. | 苯酚遇石蕊显红色 | B. | 食用花生油能发生水解反应 | ||
| C. | 包装用材料聚氯乙烯属于烃 | D. | PX项目中的对二甲苯属于饱和烃 |
17.下列物质能通过化合反应得到的是( )
①FeCl2
②Fe(OH)3
③Fe3O4
④FeCl3.
①FeCl2
②Fe(OH)3
③Fe3O4
④FeCl3.
| A. | 全部 | B. | ③④ | C. | ①②③ | D. | ②③④ |
14.下列关于化学键的说法,正确的是( )
| A. | 化合物中一定没有非极性键 | |
| B. | 单质中不可能含有离子键 | |
| C. | 金属元素与非金属元素间形成的键均是离子键 | |
| D. | CO2、CH4分子中每个原子最外层均形成了8电子结构 |
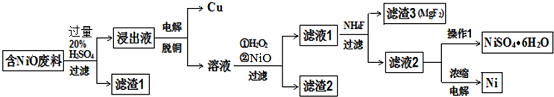
1.某NiO的废料中有FeO、CuO、Al2O3、MgO、SiO2等杂质,用此废料提取NiSO4和Ni的流程如图:
已知:有关金属离子生成氢氧化物沉淀所需的pH如表:
(1)滤渣1的主要成分为SiO2.
(2)从滤液2中获得NiSO4•6H2O的实验操作加热浓缩、冷却结晶、过滤、洗涤、干燥.
(3)用离子方程式解释加入H2O2的作用2H++H2O2+2Fe2+═2Fe3++2H2O.
(4)加NiO调节溶液的pH至5,则生成沉淀的离子方程式有2Fe3++3NiO+3H2O=2Fe(OH)3+3Ni2+、2Al3++3NiO+3H2O=2Al(OH)3+3Ni2+.
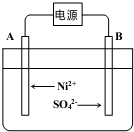
(5)电解浓缩后的滤液2可获得金属镍,其基本 反应原理如图:
①A电极反应式为Ni2++2e-=Ni和2H++2e-═H2↑.
②若一段时间后,在A、B两极均收集到11.2L气体(标准状况下),能得到Ni29.5g.

已知:有关金属离子生成氢氧化物沉淀所需的pH如表:
| 物质 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀 | 1.5 | 3.6 | 7.3 | 7.0 | 9.6 |
| 完全沉淀 | 3.8 | 4.7 | 9.3 | 9.0 | 12.0 |
(2)从滤液2中获得NiSO4•6H2O的实验操作加热浓缩、冷却结晶、过滤、洗涤、干燥.
(3)用离子方程式解释加入H2O2的作用2H++H2O2+2Fe2+═2Fe3++2H2O.
(4)加NiO调节溶液的pH至5,则生成沉淀的离子方程式有2Fe3++3NiO+3H2O=2Fe(OH)3+3Ni2+、2Al3++3NiO+3H2O=2Al(OH)3+3Ni2+.
(5)电解浓缩后的滤液2可获得金属镍,其基本 反应原理如图:
①A电极反应式为Ni2++2e-=Ni和2H++2e-═H2↑.
②若一段时间后,在A、B两极均收集到11.2L气体(标准状况下),能得到Ni29.5g.

18.CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气.CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.1KJ/mol
(1)在一定温度下,向体积为2L的密闭容器中充入0.40molCH4和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如表所示:
①计算该反应第一次达平衡时的平衡常数计算式K=$\frac{0.1×0.{3}^{3}}{0.1×0.2}$
②3min时改变的反应条件可能是升高温度、或增大H2O(g)的浓度、或减小CO的浓度 (只填一种条件的改变即可).
(2)已知温度、压强、投料比X[n(CH4)/n(H2O)]对该反应的影响如图所示.
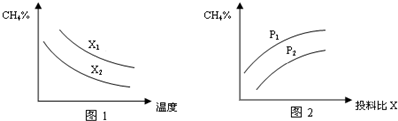
①图1中的两条曲线所示投料比的关系X1> X2(填“=”、“>”或“<”下同).
②图2中两条曲线所示的压强比的关系:P1> P2.
(3)以天然气(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池:
①放电时,负极的电极反应式为CH4-8e-+10OH-=CO32-+7H2O
②设装置中盛有的 KOH溶液,在反应后恰好生成KHCO3溶液,则该溶液中各离子浓度由大到小的关系为c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).
(1)在一定温度下,向体积为2L的密闭容器中充入0.40molCH4和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如表所示:
| 时间 浓度 物质 | 0 | 1 | 2 | 3 | 4 |
| CH4 | 0.2mol•L-1 | 0.13mol•L-1 | 0.1mol•L-1 | 0.1mol•L-1 | 0.09mol•L-1 |
| H2 | 0mol•L-1 | 0.2mol•L-1 | 0.3mol•L-1 | 0.3mol•L-1 | 0.33mol•L-1 |
②3min时改变的反应条件可能是升高温度、或增大H2O(g)的浓度、或减小CO的浓度 (只填一种条件的改变即可).
(2)已知温度、压强、投料比X[n(CH4)/n(H2O)]对该反应的影响如图所示.

①图1中的两条曲线所示投料比的关系X1> X2(填“=”、“>”或“<”下同).
②图2中两条曲线所示的压强比的关系:P1> P2.
(3)以天然气(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池:
①放电时,负极的电极反应式为CH4-8e-+10OH-=CO32-+7H2O
②设装置中盛有的 KOH溶液,在反应后恰好生成KHCO3溶液,则该溶液中各离子浓度由大到小的关系为c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).
19.下列有关物质的性质和应用均正确的是( )
| A. | 酒精能使蛋白质变性,医学上使用无水酒精来杀菌消毒 | |
| B. | NH3溶于水后显碱性,在FeCl3饱和溶液中通入足量NH3可制取Fe(OH)3胶体 | |
| C. | ClO2具有强氧化性,可用于自来水的杀菌消毒,有优于氯气的高效安全性 | |
| D. | Na2CO3能与盐酸反应,广泛用于治疗胃酸过多 |
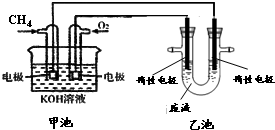 氯化铁溶液常作印刷电路铜板的腐蚀剂,得 到含有Cu2+等的废液,有人提出可以利用如图的装置从得到的废液中提炼金属铜.该过程中甲池负极的电极反应式是CH4+10OH--8e-=CO32-+7H2O,若乙池中装入废液500mL,当阴极增重3.2g时,停止通电,此时阳极产生气体的体积(标准状况)为1.12L(假设气体全部逸出).
氯化铁溶液常作印刷电路铜板的腐蚀剂,得 到含有Cu2+等的废液,有人提出可以利用如图的装置从得到的废液中提炼金属铜.该过程中甲池负极的电极反应式是CH4+10OH--8e-=CO32-+7H2O,若乙池中装入废液500mL,当阴极增重3.2g时,停止通电,此时阳极产生气体的体积(标准状况)为1.12L(假设气体全部逸出).