题目内容
15.将一定量的锌放入100mL稀盐酸中,恰好完全反应,收集到1.12L(标准状况)的H2,试计算:(1)锌的质量是3.25g.
(2)原稀盐酸的物质的量浓度是1.0mol•L-1.
分析 (1)根据转移电子守恒计算消耗m(Zn);
(2)根据H原子守恒计算原稀盐酸的物质的量浓度.
解答 解:(1)氧化还原反应中转移电子守恒,该反应中Zn失去电子物质的量等于生成氢气得到电子物质的量,n(H2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,根据转移电子守恒m(Zn)=$\frac{0.05mol×2}{2}×65g/mol$=3.25g,
故答案为:3.25;
(2)稀盐酸恰好完全反应生成氢气,根据H原子守恒得n(HCl)=2n(H2)=2×0.05mol=0.1mol,则c(HCl)=$\frac{0.1mol}{0.1L}$=1.0mol/L,故答案为:1.0.
点评 本题考查化学方程式的有关计算,侧重考查学生分析计算能力,明确转移电子守恒、原子守恒是解本题关键,题目难度不大.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
6.下列属于碱性氧化物的是( )
| A. | SO2 | B. | MgO | C. | H2O | D. | CO2 |
3.下列关于物质的分类中正确的是( )
| A. |  卤代烃 卤代烃 | B. |  羧酸 羧酸 | C. |  醛 醛 | D. |  醇 醇 |
7.完全沉淀相同体积的NaCl、MgCl2、AlCl3溶液中的Cl-,消耗等物质的量的AgNO3,则原NaCl、MgCl2、AlCl3溶液的物质的量浓度之比为( )
| A. | 1:2:3 | B. | 3:2:1 | C. | 9:3:1 | D. | 6:3:2 |
4.下列物质中既含有共价键又含离子键的化合物是( )
| A. | MgCl2 | B. | NaOH | C. | O2 | D. | C6H6 |

 ;Cl-
;Cl-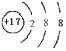 .
.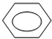 +HO-NO2→
+HO-NO2→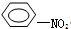 +H2O.
+H2O.