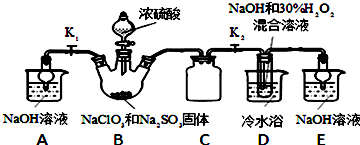
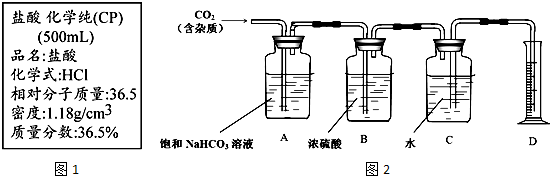
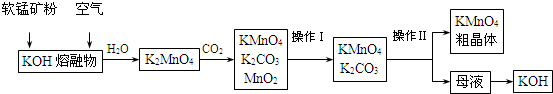
题目内容
13.将磷肥生产中形成的副产物石膏(CaSO4•2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料.无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义.下图为石膏转化为硫酸钾和氯化钙的工艺流程示示意图.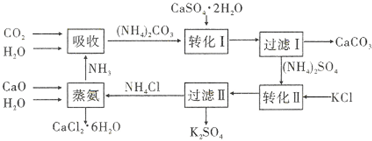
(1)过滤I操作所得固体中,除CaCO3外还含有CaSO4 (填化学式)等物质,该固体可用作生产水泥的原料.
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式:CaSO4+CO32-=CaCO3+SO42-;
(3)本工艺中所用的原料除CaSO4•2H2O,KCl外,还需要CaCO3(或CaO)、NH3、H2O等原料.
(4)过滤I操作所得滤液是(NH4)2SO4溶液.检验滤液中含有CO32-的方法是用滴管取少量滤液于试管中,滴加盐酸,若产生气泡,证明滤液中含有CO32-;
(5)已知不同温度下K2SO4在100g水中达到饱和时溶解的量如下表:
| 温度(℃) | 0 | 20 | 60 |
| K2SO4溶解的量(g) | 7.4 | 11.1 | 18.2 |
(6)氯化钙结晶水合物(CaCl2•6H2O)是目前常用的无机储热材料,选择的依据是ad (填序号).
a.熔点较低(29℃熔化) b.能导电
c.能制冷 d.无毒.
分析 由制备流程可知,吸收环节中发生2NH3、CO2、H2O反应生成碳酸铵;转化Ⅰ环节中发生碳酸铵和石膏悬浊液反应生成CaCO3、(NH4)2SO4,经过滤后分离;转化Ⅱ中(NH4)2SO4和KCl的饱和溶液反应得到NH4Cl和K2SO4,经过滤Ⅱ分离出K2SO4;蒸氨环节中为CaO、H2O、NH4Cl生成为CaCl2.6H2O和NH3.氨气在流程中可循环使用,然后结合物质的性质及混合物分离提纯来解答.
解答 解:(1)CaSO4微溶且为悬浊液,故过滤Ⅰ操作所得固体中,除CaCO3外还主要含有过量微溶的CaSO4,故答案为:CaSO4;
(2)石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式为CaSO4+CO32-=CaCO3+SO42-,故答案为:CaSO4+CO32-=CaCO3+SO42-;
(3)由流程图可知,吸收环节:2NH3+CO2+H2O生成碳酸铵;转化Ⅰ环节:碳酸铵和石膏悬浊液反应生成CaCO3+(NH4)2SO4,经过滤后分离;转化Ⅱ:(NH4)2SO4和KCl的饱和溶液反应得到NH4Cl和K2SO4经过滤Ⅱ分离;蒸氨环节的为CaO、H2O、NH4Cl生成为CaCl2.6H2O和NH3.
故答案为:CaCO3(或CaO)、NH3、H2O;
(4)碳酸根离子与酸反应能生成二氧化碳,则可以用稀盐酸来验证碳酸根离子,方法为用滴管取少量滤液于试管中,滴加盐酸,若产生气泡,证明滤液中含有CO32-,
故答案为:用滴管取少量滤液于试管中,滴加盐酸,若产生气泡,证明滤液中含有CO32-;
(5)根据图表不同温度下的溶解度,结合饱和溶液质量之比等于析出晶体质量之比计算,(100+18.2):(18.2-7.4)=591:x
x=54g,
故答案为:54;
(6)氯化钙结晶水合物(CaCl2•6H2O)是目前常用的无机储热材料,是因为氯化钙结晶水合物熔点低易熔化,且无毒,与易溶于水,能导电无关,
故答案为:ad.
点评 本题考查物质的制备及混合物分离提纯的综合应用,为高频考点,把握制备流程中的反应及混合物分离方法为解答的关键,侧重分析、推断及实验能力的综合考查,注意反应原理的分析及应用,题目难度中等.

 阅读快车系列答案
阅读快车系列答案①将海带焙烧成灰(生成KI) ②加水使KI溶解,充分搅拌后过滤 ③在滤液通入足量Cl2
④加CCl4振荡 ⑤静置后,用分液漏斗分液 合理的操作顺序是.
| A. | ①②③④⑤ | B. | ②⑤①③④ | C. | ①③⑤②④ | D. | ②①③⑤④ |
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可.
请回答下列问题:
(1)上述三种除杂方案都能够达到很好的效果,Fe3+、Fe2+都被转化为Fe(OH)3(填化学式)而除去.
(2)①中加入的试剂应该选择氨水为宜,其原因是不会引入新的杂质.
(3)②中除去Fe3+所发生的离子方程式为2Fe3+(aq)+3Mg(OH)2(s)═3Mg2+(aq)+2Fe(OH)3(s).
(4)下列与方案③相关的叙述中,正确的是ACDE.
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在.
| A. | 12 | B. | 14 | C. | 16 | D. | 18 |
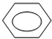 +HO-NO2→
+HO-NO2→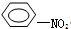 +H2O.
+H2O.