题目内容
500℃,在三个相同体积的恒容密闭容器里,分别加入对应物质,甲:2mol SO2 1mol O2乙:2mol SO2 1mol O2 1mol N2 丙:4mol SO2 2mol O2同时进行反应,开始时反应速率最大的是( )
| A、甲 | B、乙 | C、丙 | D、无法判断 |
考点:化学反应速率的影响因素
专题:
分析:体积相同,温度相同,参加反应的气体的浓度越大,则反应速率越大,以此解答该题.
解答:
解:相同温度、相同体积条件下,甲乙参加反应的气体的物质的量相等,乙中氮气不参加反应,则甲、乙反应速率相等;
丙参加气体的浓度最大,反应速率最大.
故选C.
丙参加气体的浓度最大,反应速率最大.
故选C.
点评:本题考查外界条件对反应速率的影响,难度不大,甲与乙的比较涉及氮气,不要仅仅从压强的角度分析,为易错点,根据反应的条件进行判断.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
下列说法中,正确的是( )
| A、豆油是纯净物 |
| B、油脂是高分子化合物 |
| C、糖都有甜味 |
| D、蛋白质遇福尔马林发生变性 |
下列有关化学用语使用正确的是( )
A、硫原子的原子结构示意图: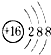 | ||
B、NH4Cl的电子式: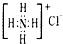 | ||
C、核内有8个中子的碳原子:
| ||
| D、HCO3-电离的离子方程式:HCO3-+H2O?CO32-+H3O+ |
在一定温度下的刚性密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应:A(s)+2B(g)?C (g)+D(g) 已达到平衡状态的是:( )
①混合气体的压强,②C的物质的量浓度,③A的物质的量,④2υ正( B)=υ逆(C ),⑤混合气体的平均相对分子质量.
①混合气体的压强,②C的物质的量浓度,③A的物质的量,④2υ正( B)=υ逆(C ),⑤混合气体的平均相对分子质量.
| A、②④⑤ | B、②③④ |
| C、①②③ | D、②③⑤ |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH.下列叙述不正确的是( )
| 放电 |
| 充电 |
| A、放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2 |
| B、充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O |
| C、放电时每转移3mol电子,正极有1molK2FeO4被氧化 |
| D、放电时的正极在充电时须接电源正极 |
下列有关结构和性质的说法正确的是( )
| A、元素铯的两种核素137Cs比133Cs多4个质子 |
| B、元素P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强 |
| C、元素原子的最外层电子数越多,越容易得电子 |
| D、从上到下,第VIIA族元素氢化物的热稳定性和还原性均依次减弱 |
镁、铝、锌、铁四种金属共20g,使其与稀硫酸恰好完全反应,将反应后所得溶液蒸干,得固体116g,则反应过程中产生气体的体积在标准状况下约为( )
| A、44.8L | B、33.6L |
| C、22.4L | D、无法确定 |
