题目内容
2.为测定某有机化合物A的结构,进行如下实验.【分子式的确定】
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4gH2O和8.8gCO2,消耗氧气6.72L(标准状况下).则该物质的实验式是C2H6O;
(2)质谱仪测定有机物A的相对分子质量为46,则该物质的分子式是C2H6O;
(3)预测A的可能结构并写出结构简式CH3CH2OH或CH3OCH3.
【结构式的确定】
(4)核磁共振氢原子光谱能对有机物分子中不同位置的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目.例如:甲基氯甲基醚(Cl-CH2-O-CH3)有两种氢原子(下左图).经测定,有机物A的核磁共振氢谱图如下右图,则A的结构简式为CH3CH2OH.

【性质实验】
(5)A在一定条件下脱水可生成B,B可合成包装塑料C,请写出B转化为C的化学反应方程式:
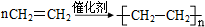 .
.(6)体育比赛中当运动员肌肉扭伤时,队医随即用氯乙烷(沸点为12.27℃)对受伤部位进行局部冷冻麻醉.请用B选择合适的方法制备氯乙烷,要求原子利用率为100%,请写出制备反应方程式:CH2=CH2 +HCl$→_{△}^{催化剂}$CH3CH2 Cl.
(7)A可通过粮食在一定条件下制得,由粮食制得的A在一定温度下密闭储存,因为发生一系列的化学变化而变得更醇香.请写出最后一步反应的化学方程式:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
分析 (1)浓硫酸增重为水的质量,碱石灰增重为二氧化碳的质量,以此可确定有机物中C、H原子个数比值,结合消耗氧气的体积可确定有机物中各原子个数比值;
(2)根据有机物原子个数比值可确定最简式,结合相对分子质量可确定有机物分子式;
(3)根据有机物分子式结合价键理论可确定有机物的可能结构;
(4)有机物A分子中有三种不同化学环境的氢原子,应为乙醇,二甲醚只有一种不同化学环境的氢原子;
(5)乙醇在一定条件下脱水可生成B,B为CH2=CH2,B可合成包装塑料C,C为聚乙烯;
(6)原子利用率为100%,可用乙烯与HCl加成方法制备氯乙烯;
(7)A可通过粮食在一定条件下制得,由粮食制得的A在一定温度下密闭储存,因为发生一系列的化学变化而变得更醇香,发生的反应中最后一步为乙醇和乙酸在浓硫酸加热反应生成乙酸乙酯和水;
解答 解:(1)由题意可知n(H2O)=$\frac{5.4g}{18g/mol}$=0.3mol,n(CO2)=$\frac{8.8g}{44g/mol}$=0.2mol,n(O2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,
根据氧原子守恒可知有机物中含有n(O)=0.3mol+0.2mol×2-0.3mol×2=0.1mol,
则有机物中N(C):N(H):N(O)=0.2mol:0.6mol:0.1mol=2:6:1,则该物质的实验式是C2H6O,
故答案为:C2H6O;
(2)该物质中各元素的原子个数比为N(C):N(H):N(O)=2:6:1,则最简式为C2H6O,其相对分子质量为46,则有机物的分子式为C2H6O,
故答案为:C2H6O;
(3)有机物的分子式为C2H6O,分子中可能存在C-C、C-H、C-O、O-H等化学键,可能的结构简式有CH3CH2OH或CH3OCH3,
故答案为:CH3CH2OH或CH3OCH3;
(4)有机物A分子中有三种不同化学环境的氢原子,应为乙醇,即CH3CH2OH,二甲醚只有一种不同化学环境的氢原子,
故答案为:CH3CH2OH;
(5)乙醇在一定条件下脱水可生成B,B为CH2=CH2,B可合成包装塑料C,C为聚乙烯,反应的化学方程式为: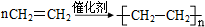 ,
,
故答案为: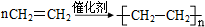 ;
;
(6)原子利用率为100%,可用乙烯与HCl加成方法制备氯乙烷,反应的方程式为nCH2=CH2 +HCl$→_{△}^{催化剂}$CH3CH2 Cl,
故答案为:CH2=CH2 +HCl$→_{△}^{催化剂}$CH3CH2 Cl.
(7)A可通过粮食在一定条件下制得,由粮食制得的A在一定温度下密闭储存,因为发生一系列的化学变化而变得更醇香,发生的反应中最后一步为乙醇和乙酸在浓硫酸加热反应生成乙酸乙酯和水,反应的化学方程式为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$ CH3COOCH2CH3+H2O,
故答案为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$ CH3COOCH2CH3+H2O;
点评 本题考查有机物的推断,题目难度中等,本题注意从质量守恒的角度判断有机物最简式是解答该题的关键,学生应熟练掌握有机物质性质.

 习题精选系列答案
习题精选系列答案| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能如下: |
| I1=738kJ•mol-1 I2=1451kJ•mol-1 I3=7733kJ•mol-1 I4=10540kJ•mol-1 |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
 .
.(2)B元素基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈哑铃形.
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为
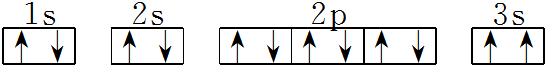 该同学所画的电子排布图违背了泡利原理.
该同学所画的电子排布图违背了泡利原理.(4)G位于ⅦB族d区,该元素的核外电子排布式为1s22s22p63s23p63d54s2.
(5)检验F元素的实验方法是焰色反应.
| A. | 标准状况下,22.4LH2含有的分子数为1NA | |
| B. | 常温常压下,1.06gNa2CO3含有的Na+数为0.02NA | |
| C. | 标准状况下,1NACO2分子占有的体积为22.4L | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1NA |
| A. | 合金 | B. | 硅酸盐材料 | C. | 有机高分子材料 | D. | 无机非金属材料 |
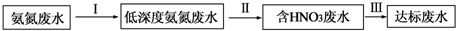

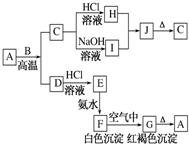 A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.
A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.