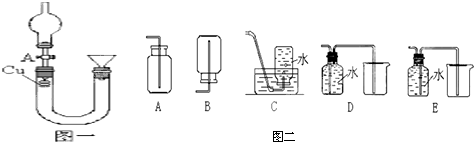
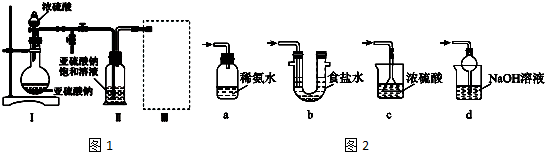
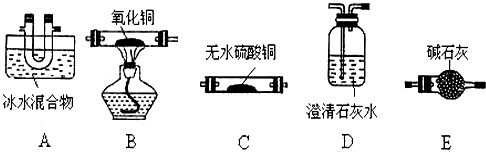
题目内容
2.铁可以形成多种氧化物、氢氧化物和盐类.铁与二氧化碳、水在某一密闭体系中反应情况如下表所示:| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
| ⅠFe(s)+CO2(g)=FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ⅡFe(s)+H2O(g)=FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ⅢCO(g)+H2O(g)=CO2(g)+H2(g) | K3 | ? | ? |
(1)反应Ⅰ是吸热(选填“吸热”,“放热”)反应.根据反应Ⅰ与Ⅱ可以推导出同温下K1、K2与K3之间的关系,则K3=$\frac{{K}_{2}}{{K}_{1}}$(用K1、K2表示).
(2)973K时,若反应Ⅲ在一个容积为2L的反应容器内2min时达到平衡,有3mol电子发生转移,则在2min内v(CO2)=0.375mol•(L•s)-1.若压缩容器的容积为原来的一半,平衡将不移动(选填“向左”,“向右”,“不”),CO2的浓度将增大(选填“增大”,“减小”,“不变”).使该反应的平衡转化率及平衡常数都增大的措施有降低温度.
分析 (1)分析平衡常数随温度升高增大,说明平衡正向进行,正反应是吸热反应;依据反应①②③的平衡常数表达式计算得到K1、K2、K3的关系;
(2)依据电子转移计算反应的二氧化碳物质的量,结合化学反应速率概念计算V=$\frac{△c}{△t}$得到;反应前后气体体积不变,改变压强平衡不动,但体积减小物质浓度增大,使该反应的平衡转化率及平衡常数都增大的措施应使平衡正向进行,计算不同温度下反应③的平衡常数,比较分析反应是吸热反应,升温平衡正向进行,平衡常数、反应物转化率增大.
解答 解:(1)平衡常数随温度升高增大,说明平衡正向进行,正反应是吸热反应,
①Fe(s)+CO2(g)=FeO(s)+CO(g),K1=$\frac{c(CO)}{c(C{O}_{2})}$,
②Fe(s)+H2O(g)=FeO(s)+H2(g),K2=$\frac{c({H}_{2})}{c({H}_{2}O)}$,
③CO(g)+H2O(g)=CO2(g)+H2(g),K3=$\frac{c({H}_{2})•c(C{O}_{2})}{c(CO)•c({H}_{2}O)}$,
所以平衡常数的关系是K3=$\frac{{K}_{2}}{{K}_{1}}$,
故答案为:吸热;$\frac{{K}_{2}}{{K}_{1}}$;
(2)973K时,若反应③在一个容积为2L的反应容器内2min时达到平衡,反应CO(g)+H2O(g)=CO2(g)+H2(g),每反应生成1molCO2,电子转移2mol,有3mol电子发生转移,反应的二氧化碳物质的量为1.5mol,则在2min内v(CO2)=$\frac{\frac{1.5mol}{2L}}{2min}$=0.375 mol•(L•s)-1;
若压缩容器的容积为原来的一半,反应前后是气体体积不变的反应,平衡不移动,CO2的浓度将增大,依据(1)计算可知K3=$\frac{{K}_{2}}{{K}_{1}}$,973K时K3=$\frac{2.38}{1.47}$=1.62,1173K时K3=$\frac{1.67}{2.15}$=0.78,所以随温度升高,反应③平衡常数减小,说明正反应是放热反应,使该反应的平衡转化率及平衡常数都增大需要平衡正向进行,所以采取的措施是降低温度;
故答案为:0.375 mol•(L•s)-1;不;增大;降低温度.
点评 本题考查了化学平衡影响因素、平衡常数的计算应用,主要是平衡移动原理的分析判断,明确化学平衡及其影响为解答关键,注意掌握化学平衡常数的概念及表达式,试题培养了学生的分析能力及化学计算能力.

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案| A. | 平衡向正反应方向移动了 | B. | 物质A的转化率减少了 | ||
| C. | 物质B的质量增重了 | D. | a>b |
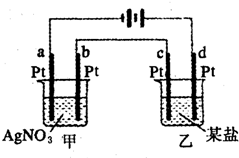 如图所示的装置,两烧杯中均为相应的水溶液,通电一段时间后,测得甲池中某电极质量增加2.16g,乙池中某电极上析出0.64g某金属,下列说法正确的是( )
如图所示的装置,两烧杯中均为相应的水溶液,通电一段时间后,测得甲池中某电极质量增加2.16g,乙池中某电极上析出0.64g某金属,下列说法正确的是( )| A. | 甲池是b极上析出金属银,乙池是c极上析出某金属 | |
| B. | 甲池是a极上析出金属银,乙池是d极上析出某金属 | |
| C. | 某盐溶液可能是CuSO4溶液 | |
| D. | 某盐溶液可能是Mg(NO3)2溶液 |
 某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.
某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊.A受热分解的化学方程式为2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
(2)称取两种固体各2g,分别加入两个小烧杯中,再各加10mL 蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复至室温,向所得溶液中各滴入2滴酚酞溶液.
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论同温度下,Na2CO3比NaHCO3易溶于水.
②同学们在两烧杯中还观察到以下现象.其中,盛放Na2CO3的烧杯中出现的现象是b、d(填字母序号).
a.溶液温度下降 b.溶液温度升高
c.滴入酚酞后呈浅红色 d.滴入酚酞后呈红色
(3)如图所示,在气密性良好的装置Ⅰ和Ⅱ中分别放入药品,将气球内的固体同时倒入试管中.
①两试管中均产生气体,Ⅰ(填“Ⅰ”或“Ⅱ”)的反应程度更为剧烈.
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是a、c.
a.装置 I的气球体积较大 b.装置Ⅱ的气球体积较大
c.生成气体的体积根据盐酸计算 d.生成气体的体积根据固体计算
(4)同学们将两种固体分别配制成0.5mol•L-1的溶液,设计如下方案并对反应现象做出预测:
| 实验方案 | 预测现象 | 预测依据 |
| 操作1:向2mL Na2CO3溶液中滴加1mL 0.5mol•L-1CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应Ca2++CO32-=CaCO3↓(写离子方程式).Ca2++CO32-=CaCO3↓ |
| 操作2:向2mL NaHCO3溶液中滴加少量的澄清石灰水 | 白色沉淀 | 反应的离子方程式为Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O |
| A. | 1 mol H2O 的质量是18 g/mol | |
| B. | CH4 的摩尔质量是16 g | |
| C. | 标准状况下,1 mol 任何物质的体积均为22.4 L | |
| D. | 3.01×1023个O2分子的质量是16 g |
| A. | Fe2+、H+、MnO4-、Cl- | B. | Na+、Mg2+、NO3-、Cl- | ||
| C. | H+、K+、SO42-、ClO- | D. | Ba2+、K+、OH-、CO32- |