题目内容
5.在密闭容器中,一定条件下进行如下反应:NO(g)+CO(g)?$\frac{1}{2}$N2(g)+CO2(g);△H=-373.2kJ•mol-1达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
| A. | 加催化剂同时升高温度 | B. | 加催化剂同时增大压强 | ||
| C. | 升高温度同时充入N2 | D. | 降低温度同时减小压强 |
分析 该反应为气体体积减小、放热的反应,催化剂、升高温度均可加快反应速率,但催化剂对平衡移动无影响,升高温度平衡逆向移动,以此来解答.
解答 解:A.升高温度平衡逆向移动,NO的转化率减小,故A不选;
B.加催化剂可加快反应速率,增大压强,反应速率增大、平衡正向移动,NO的转化率增大,故B选;
C.升高温度同时充入N2,平衡逆向移动,NO的转化率减小,故C不选;
D.降低温度、降低压强,反应速率均减小,故D不选;
故选B.
点评 本题考查化学平衡,为高频考点,把握反应速率及化学平衡的影响因素为解答的关键,侧重分析与应用能力的考查,注意化学反应的特点,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.四个试管中都装有5mL0.1mol/LNa2SO3溶液,分别在不同温度下加入0.1mol/L硫酸和一定量水,最先出现浑浊的是( )
| A. | 20℃,4 mL硫酸,6 mL水 | B. | 20℃,5 mL硫酸,5 mL水 | ||
| C. | 30℃,5 mL硫酸,5 mL水 | D. | 30℃,4 mL硫酸,6 mL水 |
16.在某100mL混合酸中,HNO3物质的量浓度为0.4mol/L,H2SO4物质的量浓度为0.2mol/L.向其中加入1.92克铜粉微热,待充分反应后,溶液中的Cu2+物质的量浓度为( )
| A. | 0.15mol/L | B. | 0.3mol/L | C. | 0.225mol/L | D. | 无法计算 |
13.下列实验装置图能达到实验目的是( )
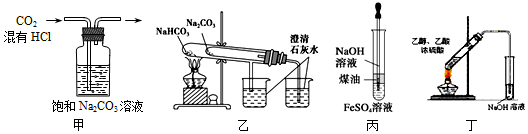

| A. | 图甲可除去CO2种混有的HCl气体 | |
| B. | 图乙可用于比较Na2CO3和NaHCO3的热稳定性 | |
| C. | 图丙可制得Fe(OH)2沉淀且一定时间内不变质 | |
| D. | 图丁可制得并分离出乙酸乙酯 |
10.某有机物的结构简式如图所示  ,下列有关该有机物说法正确的是( )
,下列有关该有机物说法正确的是( )
 ,下列有关该有机物说法正确的是( )
,下列有关该有机物说法正确的是( )| A. | 该有机物的化学式为C10H14 | |
| B. | 它的一氯代物有6种 | |
| C. | 它的分子中所有的碳原子一定在同一平面上 | |
| D. | 一定条件下,它可以发生取代、加成、氧化和还原反应 |
19. 常温常压下,某生物燃料电池(BFC)以乙醇为燃料,直接或间接利用酶作催化剂,其总反应为C2H5OH+3O2?2CO2+3H2O,其工作原理如图所示.下列有关说法正确的是( )
常温常压下,某生物燃料电池(BFC)以乙醇为燃料,直接或间接利用酶作催化剂,其总反应为C2H5OH+3O2?2CO2+3H2O,其工作原理如图所示.下列有关说法正确的是( )
 常温常压下,某生物燃料电池(BFC)以乙醇为燃料,直接或间接利用酶作催化剂,其总反应为C2H5OH+3O2?2CO2+3H2O,其工作原理如图所示.下列有关说法正确的是( )
常温常压下,某生物燃料电池(BFC)以乙醇为燃料,直接或间接利用酶作催化剂,其总反应为C2H5OH+3O2?2CO2+3H2O,其工作原理如图所示.下列有关说法正确的是( )| A. | 乙醇发生还原反应 | |
| B. | b极上的电极反应式为O2+4e-+H2O--4OH- | |
| C. | 电池工作时,电解液中的H+由a极向b极迁移 | |
| D. | 当外电路中有1.2 mol电子转移时,能产生4.48 L CO2 |
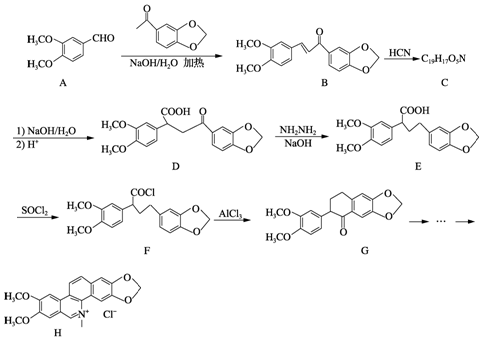
 ;由E→F的反应类型为取代.
;由E→F的反应类型为取代. .
. ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).
 +CH3Cl$\stackrel{AlCl_{3}}{→}$
+CH3Cl$\stackrel{AlCl_{3}}{→}$ +HCl
+HCl .
. .
. .
. .
.