题目内容
7.下列溶液蒸干后并灼烧,得到的固体物质是原溶质的是( )| A. | AlCl3溶液 | B. | NaHCO3溶液 | C. | NH4HCO3溶液 | D. | Fe2(SO4)3溶液 |
分析 加热蒸干并灼烧的过程中,要注意考虑盐的水解平衡的移动、物质的氧化、物质的分解等情况,氯化铝易水解,碳酸氢钠、NH4HCO3溶液加热易分解,硫酸铁溶液.解说词氢氧化铁和硫酸,硫酸难挥发.
解答 解:A.促进氯化铝水解,且氯化氢有挥发性,导致蒸干时得到氢氧化铝固体,再将固体灼烧,氢氧化铝分解生成氧化铝和水,则最后得到的固体是氧化铝,故A错误;
B.灼烧碳酸氢钠时碳酸氢钠分解生成碳酸钠、二氧化碳和水,所以最后得到的是碳酸钠,故B错误;
C.碳酸氢铵不稳定,加热分解生成氨气、二氧化碳气体和水,故C错误;
D.加热促进硫酸铁水解,但硫酸没有挥发性,所以蒸干时得到的固体是硫酸铁,灼烧硫酸铁,硫酸铁不分解,所以最后得到的固体仍然是硫酸铁,故D正确;
故选D.
点评 本题以盐类水解为载体考查了物质的性质,明确物质的性质是解本题关键,注意蒸发灼烧氯化铝和硫酸铁溶液时得到固体不同,根本原因是酸的性质不同,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.在共价化合物中,化合价有正负的原因是( )
| A. | 有共用电子对偏移 | |
| B. | 有电子得失 | |
| C. | 既有电子得失,又有共用电子对偏移 | |
| D. | 存在共价键 |
18.下列化学反应的离子方程式正确的是( )
| A. | 氢氧化镁中滴加盐酸:H++OH-═H2O | |
| B. | Cl2通入水中:Cl2+H2O═2 H++Cl-+ClO- | |
| C. | 金属铝溶于氢氧化钠溶液:2Al+6OH-═2AlO2-+3H2↑ | |
| D. | 用FeCl3溶液腐蚀铜电路板:2Fe3++Cu═2Fe2++Cu2+ |
15.氢化钠与水反应:NaH+H2O=NaOH+H2↑,对该反应的描述正确的是( )
| A. | NaH是氧化剂 | B. | H2O是氧化剂 | ||
| C. | 氧化剂与还原剂的质量比为1:1 | D. | 每生成1molH2转移2mol电子 |
2.下列有关实验装置进行的相应实验,能达到实验目的是( )


| A. | 用图①所示装置除去Cl2中含有的少量HCl | |
| B. | 用图②所示装置制备并收集O2 | |
| C. | 用图③所示装置制取少量的CO2气体 | |
| D. | 用图④所示装置分离汽油萃取碘水后已分层的有机层和水层 |
12.下列有关原电池说法中正确的是( )
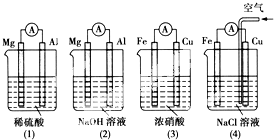

| A. | (1)(2)中活泼的Mg均作负极 | |
| B. | (2)中Mg作正极,电极反应式为6H2O+6e-=6OH-+3H2↑ | |
| C. | (3)中Fe作负极,电极反应式为Fe-2e-=Fe2+ | |
| D. | (4)中Cu作正极,电极反应式为2H++2e-=H2↑ |
17.在通常条件下,下列各组物质的性质排列正确的是( )
| A. | 熔点:CO2>KCl>SiO2 | B. | 水溶性:HCl>Cl2>CO2 | ||
| C. | 沸点:Cl2>Br2>I2 | D. | 热稳定性:HI>HBr>HCl |