题目内容
18.下列化学反应的离子方程式正确的是( )| A. | 氢氧化镁中滴加盐酸:H++OH-═H2O | |
| B. | Cl2通入水中:Cl2+H2O═2 H++Cl-+ClO- | |
| C. | 金属铝溶于氢氧化钠溶液:2Al+6OH-═2AlO2-+3H2↑ | |
| D. | 用FeCl3溶液腐蚀铜电路板:2Fe3++Cu═2Fe2++Cu2+ |
分析 A.氢氧化镁在离子反应中保留化学式;
B.反应生成的HClO在离子反应中保留化学式;
C.漏写氧化剂水;
D.电子、电荷守恒.
解答 解:A.氢氧化镁中滴加盐酸的离子反应为Mg(OH)2+2H+═2H2O+Mg2+,故A错误;
B.Cl2通入水中的离子反应为Cl2+H2O═H++Cl-+HClO,故B错误;
C.金属铝溶于氢氧化钠溶液的离子反应为2Al+2H2O+2OH-═2AlO2-+3H2↑,故C错误;
D.用FeCl3溶液腐蚀铜电路板的离子反应为2Fe3++Cu═2Fe2++Cu2+,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
8.下列化合物中,不能由化合反应直接制得的是( )
| A. | FeCl3 | B. | FeCl2 | C. | FeS | D. | Al(OH)3 |
9.同浓度的下列水溶液中,溶液H+浓度最大的是( )
| A. | HCl | B. | H2CO3 | C. | H2SO4 | D. | CH3COOH |
6.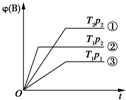 已知某可逆反应mA(g)+nB(g)?pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数[φ(B)]的关系曲线,由曲线分析,下列判断正确的是( )
已知某可逆反应mA(g)+nB(g)?pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数[φ(B)]的关系曲线,由曲线分析,下列判断正确的是( )
 已知某可逆反应mA(g)+nB(g)?pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数[φ(B)]的关系曲线,由曲线分析,下列判断正确的是( )
已知某可逆反应mA(g)+nB(g)?pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数[φ(B)]的关系曲线,由曲线分析,下列判断正确的是( )| A. | T1<T2,p1>p2,m+n>p,放热反应 | B. | T1>T2,p1<p2,m+n>p,吸热反应 | ||
| C. | T1<T2,p1>p2,m+n<p,放热反应 | D. | T1>T2,p1<p2,m+n<p,吸热反应 |
13.下列各组物质的无色溶液,不用其它试剂即可鉴别的是( )
| A. | KOH Na2SO4 HCl | B. | NaHCO3 NaNO3 H2SO4 | ||
| C. | HCl Na2CO3 NaCl | D. | Ca(OH)2 Na2CO3 BaCl2 |
3.在某无色透明溶液中,能共存的离子组是( )
| A. | Na+、SO42-、Cu2+、Cl- | B. | Fe2+、NO3-、Na+、Al3+ | ||
| C. | Mg2+、H+、Cl-、NO3- | D. | Ag+、K+、NO3-、Cl- |
10.海洋中有丰富的“食品、矿产、能源、药物和水产资源”等,下列说法正确的是( )
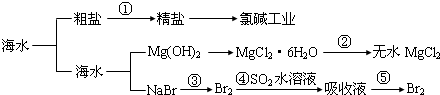

| A. | 第①步中除去泥沙及Ca2+、Mg2+等杂质时,不涉及化学变化过程 | |
| B. | 工业上,通过电解“精盐”水溶液可以制取金属钠 | |
| C. | 第②步的反应条件是“在空气中直接加热” | |
| D. | 第③、④、⑤步中均涉及氧化还原反应 |
7.下列溶液蒸干后并灼烧,得到的固体物质是原溶质的是( )
| A. | AlCl3溶液 | B. | NaHCO3溶液 | C. | NH4HCO3溶液 | D. | Fe2(SO4)3溶液 |
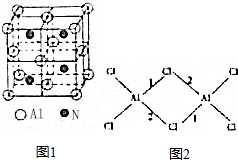
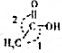 ,CH3COOH分子中σ键与π键个数之比7:1,分子中键角1<键角2(填“>”、“=”或“<”).
,CH3COOH分子中σ键与π键个数之比7:1,分子中键角1<键角2(填“>”、“=”或“<”).