题目内容
16.某氧化铜(CuO)粉末中混有少量氧化亚铜(Cu2O),课外活动小组的同学利用如图所示装置测定其中Cu2O的含量,请根据图示内容回答下列问题: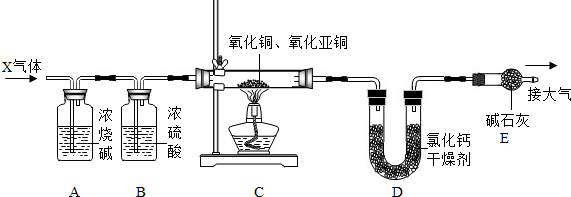
(1)X是H2(可能混有少量水和二氧化碳),A装置的作用是吸收二氧化碳,B装置的作用是干燥氢气.
(2)已知Cu2O在加热条件下也能被H2还原为Cu,反应的化学方程式为Cu2O+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+H2O.
(3)已知反应前混合物的总质量为22.4g,待装置冷却后停止通入H2,测得U型管内物质的质量增加了3.6g,则原混合物中Cu2O的质量为6.8g.
(4)若没有E装置,则测得的Cu2O的质量偏低(填“偏高”、“偏低”、“无影响”)
分析 (1)由题意可知,实验目的是测定氧化铜和氧化亚铜混合物中氧化亚铜的含量,反应原理是利用还原性气体夺氧,氢气夺氧生成的水被氯化钙吸收,D装置质量增加量为生成的水的质量,已知氧化铜和氧化亚铜混合物的质量和生成水的质量,根据相关的化学方程式就可求出氧化亚铜的质量,确定混合物中其含量,为了实验的准确性,参加反应的氢气要进行干燥和除二氧化碳;
(2)Cu2O在加热条件下也能被H2还原为Cu,根据元素守恒书写化学方程式;
(3)已知反应前混合物的总质量为22.4g,完全反应后U型管内物质的质量增加了3.6g为水的质量,设原混合物中 Cu2O的质量为X,它与H2反应生成水的质量为Y,那么CuO的质量为:22.4g-X,它与H2反应生成水的质量为3.6g-Y,依据化学方程式定量关系计算得到;
(4)当D与外界连通时,氯化钙会吸收空气中的水蒸气,使测得水的质量出现偏差,所以加E装置,用以防止空气中的水蒸气进入D装置,如果没E装置,则测得的产物水的质量偏大,据此分析.
解答 解:(1)由题意可知,实验目的是测定氧化铜和氧化亚铜混合物中氧化亚铜的含量,反应原理是利用还原性气体夺氧,氢气夺氧生成的水被氯化钙吸收,D装置质量增加量为生成的水的质量,已知氧化铜和氧化亚铜混合物的质量和生成水的质量,根据相关的化学方程式就可求出氧化亚铜的质量,确定混合物中其含量,为了实验的准确性,参加反应的氢气要进行干燥和除二氧化碳,所以装置A的作用是吸收二氧化碳,装置B的作用是干燥氢气,
故答案为:吸收二氧化碳;干燥氢气;
(2)Cu2O在加热条件下也能被H2还原为Cu,反应的化学方程式为Cu2O+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+H2O,
故答案为:Cu2O+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+H2O;
(3)已知反应前混合物的总质量为22.4g,完全反应后U型管内物质的质量增加了3.6g为水的质量,设原混合物中 Cu2O的质量为X,它与H2反应生成水的质量为Y,那么CuO的质量为:22.4g-X,它与H2反应生成水的质量为3.6g-Y,
CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O
80 18
22.4g-X 3.6g-Y
Cu2O+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+H2O
144 18
X Y
$\left\{\begin{array}{l}{18(22.4g-X)=80(3.6g-Y)}\\{144Y=18X}\end{array}\right.$
解方程组得:X=6.8g;
所以原混合物中Cu2O的质量为6.8g,
故答案为:6.8g;
(4)当D与外界连通时,氯化钙会吸收空气中的水蒸气,使测得水的质量出现偏差,所以加E装置,用以防止空气中的水蒸气进入D装置,如果没E装置,则测得的产物水的质量偏大,由于单位质量的氧化亚铜产生水的质量小于氧化铜,所以生成的水越多,氧化铜的含量越大,所以测得的Cu2O的质量分数偏低;
故答案为:偏低;
点评 该题是一道综合实验题,实验设计严密,考查的知识点较多,解题的关键是明确实验目的和原理,分析综合装置各部分的作用,题目难度中等.

 阅读快车系列答案
阅读快车系列答案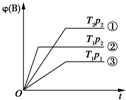 已知某可逆反应mA(g)+nB(g)?pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数[φ(B)]的关系曲线,由曲线分析,下列判断正确的是( )
已知某可逆反应mA(g)+nB(g)?pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数[φ(B)]的关系曲线,由曲线分析,下列判断正确的是( )| A. | T1<T2,p1>p2,m+n>p,放热反应 | B. | T1>T2,p1<p2,m+n>p,吸热反应 | ||
| C. | T1<T2,p1>p2,m+n<p,放热反应 | D. | T1>T2,p1<p2,m+n<p,吸热反应 |
| A. | AlCl3溶液 | B. | NaHCO3溶液 | C. | NH4HCO3溶液 | D. | Fe2(SO4)3溶液 |
| A. | 电离常数Ka | B. | 化学平衡常数K | ||
| C. | 水的离子积常数Kw | D. | 盐的水解常数Kh |

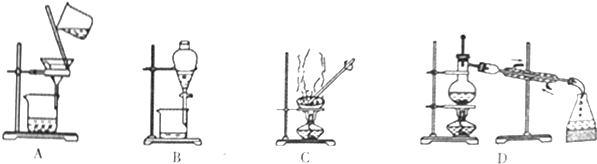
| A. | 用1从碘水中分离出碘 | B. | 用2检验试液中NH4+的存在 | ||
| C. | 用3干燥SO2气体 | D. | 用4收集HCl气体 |
| A. | SiH4、NH3、HF、CH4 | B. | SiH4、CH4、NH3、HF | C. | HF、CH4、SiH4、NH3 | D. | NH3、HF、CH4、SiH4 |

| A. | 9 | B. | 10 | C. | 11 | D. | 12 |
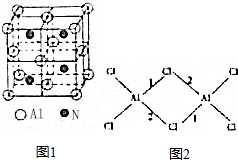
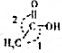 ,CH3COOH分子中σ键与π键个数之比7:1,分子中键角1<键角2(填“>”、“=”或“<”).
,CH3COOH分子中σ键与π键个数之比7:1,分子中键角1<键角2(填“>”、“=”或“<”).