题目内容
以下说法中正确的是( )
| A、相同温度下,1 mol/L氨水溶液与0.5 mol/L氨水溶液中c(OH-) 之比为2:1 |
| B、NH4Cl 溶液中,c(NH4+)=c(Cl -) |
| C、向0.1 mol/L NaNO3溶液中滴加稀盐酸,使溶液pH=5,此时混合液中c(Na+)=c(NO3-) |
| D、向醋酸钠溶液中加入适量醋酸,使混合液的pH=7,此时混合液中c(Na+)=c(CH3COO-) |
考点:离子浓度大小的比较
专题:电离平衡与溶液的pH专题
分析:A.相同温度下,一水合氨电离程度与浓度成反比;
B.氯化铵是强酸弱碱盐,溶液呈酸性,溶液中存在电荷守恒,根据电荷守恒判断;
C.钠离子和硝酸根离子都不水解,溶液中存在物料守恒;
D.混合溶液呈中性,则c(H+)═c(OH-),溶液中存在电荷守恒,根据电荷守恒判断.
B.氯化铵是强酸弱碱盐,溶液呈酸性,溶液中存在电荷守恒,根据电荷守恒判断;
C.钠离子和硝酸根离子都不水解,溶液中存在物料守恒;
D.混合溶液呈中性,则c(H+)═c(OH-),溶液中存在电荷守恒,根据电荷守恒判断.
解答:
解:A.相同温度下,一水合氨电离程度与浓度成反比,所以相同温度下,1 mol/L氨水溶液与0.5 mol/L氨水溶液中c(OH-) 之比小于2:1,故A错误;
B.氯化铵是强酸弱碱盐,溶液呈酸性,溶液中存在电荷守恒,根据电荷守恒得c(NH4+)<c(Cl -),故B错误;
C.钠离子和硝酸根离子都不水解,溶液中存在物料守恒,根据物料守恒得c(Na+)=c(NO3-),故C正确;
D.混合溶液呈中性,则c(H+)=c(OH-),溶液中存在电荷守恒,根据电荷守恒得c(Na+)=c(CH3COO-),故D正确;
故选CD.
B.氯化铵是强酸弱碱盐,溶液呈酸性,溶液中存在电荷守恒,根据电荷守恒得c(NH4+)<c(Cl -),故B错误;
C.钠离子和硝酸根离子都不水解,溶液中存在物料守恒,根据物料守恒得c(Na+)=c(NO3-),故C正确;
D.混合溶液呈中性,则c(H+)=c(OH-),溶液中存在电荷守恒,根据电荷守恒得c(Na+)=c(CH3COO-),故D正确;
故选CD.
点评:本题考查离子浓度大小比较,明确溶液中的溶质及其性质是解本题关键,注意:任何电解质溶液中都存在电荷守恒与物料守恒,与电解质溶液酸碱性、浓度无关,题目难度不大.

练习册系列答案
相关题目
某无色混合气体可能由CH4、NH3、H2、CO、CO2和HCl中的某几种气体组成.在恒温、恒压的条件下,将此混合气体通过浓硫酸时,总体积基本不变;通过过量的澄清石灰水,未见变浑浊,但混合气体的总体积减小,把剩余气体导出后,在O2中能够点燃,燃烧产物不能使CuSO4粉末变色.则混合气体一定含的成份是( )
| A、HCl、CO和CO2 |
| B、HCl、H2和CO |
| C、CH4和NH3 |
| D、HCl和CO |
一定温度下,在2L的密闭容器中发生如下反应:A(s)+2B(g)?2C(g)△H<0,反应过程中B、C的物质的量随时间变化关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图下列有关说法不正确的( )
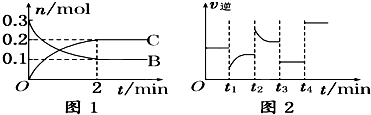

| A、反应开始2分钟内,v(B)=0.05mol/(L?min) |
| B、t1时改变的条件可能是减小了反应物的浓度 |
| C、t2时可能升高了温度 |
| D、t3时改变的条件可能是降压,此时c(B)减小 |
向50mL 18mol/L的硫酸中加入足量的铜片并加热,充分反应后,被还原的硫酸的物质的量( )
| A、小于0.45mol |
| B、等于0.45mol |
| C、在0.45mol 和0.9mol之间 |
| D、等于0.9mol |
在给定的四种溶液中加入以下各种离子,能在原溶液中较大量共存的是( )
| A、PH=1的溶液:Fe2+、Na+、Mg2+、NO3- |
| B、滴加酚酞试液显红色的溶液:Fe3+、NH4+、Cl-、NO3- |
| C、所含溶质为NaOH的溶液中:K+、SO42-、NO3-、OH- |
| D、在碱性溶液中:K+、HCO3-、Br-、Ba2+ |
向含下列离子的溶液中分别加入NaOH固体(溶液体积不变),能引起离子浓度减小的是( )
| A、Cl- |
| B、OH- |
| C、AlO2- |
| D、HCO3- |
水是我们日常生活中最宝贵的资源之一.关于水的叙述正确的是( )
| A、4℃的纯水pH为7 |
| B、水的电离方程式为:H2O?2H++O2- |
| C、重水(D2O)中,质量数是质子数的两倍 |
| D、相同质量的水具有的能量:固体>液体>气体 |
在一定温度下体积固定的容器中,可以充分说明可逆反应A(g)+3B(g)?3C(g)+D(g),达到平衡状态的是( )
| A、器内压强不随时间变化而变化 |
| B、反应器内A、B、C、D物质的量比为1:3:3:1 |
| C、生成A的速率和生成的D的速率相等 |
| D、生成 1mol A同时有3 mol C被消耗 |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s)下列说法中错误的是( )
| A、电池工作时,锌是负极,发生氧化反应 |
| B、外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
| C、电池负极的电极反应式为:Zn-2e-+2OH-═Zn(OH)2 |
| D、电池工作时,溶液中OH-向正极移动,K+、H+向负极移动 |