题目内容
13.Rm-有n个电子,它的质量数为A,则原子核内的中子数为( )| A. | A+n+m | B. | A+n-m | C. | A-n+m | D. | A-n-m |
分析 在阴离子中,阴离子的核外电子数=质子数+电荷数,质量数=质子数+中子数,所以中子数=质量数-质子数=核外电子数-电荷数.
解答 解:Rn-离子有n个电子,电荷数为m,阴离子的核外电子数=质子数+电荷数,所以质子数=核外电子数-电荷数=n-m;中子数=质量数-质子数=A-(n-m)=A-n+m,
故选C.
点评 本题考查了核外电子数、质子数、中子数、质量数、电荷数之间的关系,难度不大,明确由原子变成离子,变化的是核外电子数,不变的是核内质子数.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
8.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 标准状况下,3.36L SO3含有的原子数目为0.6NA | |
| B. | 1 molNa2O2与足量的水反应,转移的电子数为2NA | |
| C. | 在常温常压下,13.8克NO2与足量水充分反应,剩余气体的分子数为0.1NA | |
| D. | 在1 L lmol•L-1的氨水中,含有的NH3与NH3•H2O分子的总数等于1 NA |
18.下列单质或化合物性质的描述正确的是( )
| A. | NaHSO4水溶液显中性 | |
| B. | NO2溶于水时发生氧化还原反应 | |
| C. | SiO2与酸、碱均不反应 | |
| D. | Fe在足量Cl2中燃烧生成FeCl2和FeCl3 |
5.在一定条件下,硫酸铵的分解反应为:4(NH4)2SO4=N2↑+6NH3↑+3SO2↑+SO3↑+7H2O,当有nmol电子转移时,下列说法正确的是( )
| A. | 有2nmol(NH4)2SO4分解 | B. | 有$\frac{n}{2}$molS原子被氧化 | ||
| C. | 生成$\frac{n}{6}$mol氧化产物 | D. | 生成7nmolH2O |
2.下列有关物质用途的说法中,错误的是( )
| A. | 硅胶常用作袋装食品的干燥剂,也可用作催化剂的载体 | |
| B. | 过渡元素金属作半导体材料 | |
| C. | 考古时利用14C测定一些文物的年代 | |
| D. | 纯净的SiO2是现代光学及光纤制品的基本原料 |
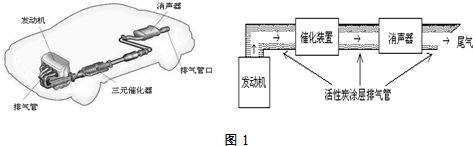
3.汽车尾气排放的一氧化碳、氮氧化物等气体已成为大气污染的主要来源.德国大众汽车尾气检测造假事件引起全世界震惊.根据下列示意图(如图1)回答有关问题:
(1)汽车发动机工作时会引发N2(g)+O2(g)=2NO(g)△H=+180kJ•mol-1,其能量变化示意图如下:
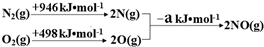
则NO中氮氧键的键能为632kJ•mol-1.
(2)空燃比过小易产生CO.有人提出可以设计反应2CO(g)=2C(s)+O2(g)来消除CO的污染.判断该设想是否可行,并说出理由不合理,该反应焓增、熵减,任何条件下都不能自发进行或该反应△H>0,△S<0则△G>0.
(3)利用活性炭涂层排气管处理NOx的反应为:xC(s)+2NOx(g)?N2(g)+xCO2 (g)△H=-b kJ•mol-1.若使NOx更加有效的转化为无毒尾气排放,以下措施理论上可行的是AD.
A.增加排气管长度 B.增大尾气排放口
C.升高排气管温度 D.添加合适的催化剂
(4)催化装置中涉及的反应之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).
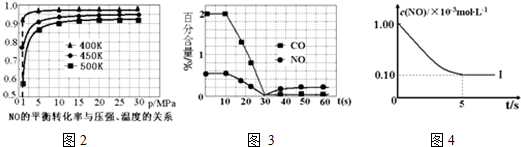
①探究上述反应中NO的平衡转化率与压强、温度的关系,得到图2所示的曲线.催化装置比较适合的温度和压强是400K,1MPa.
②测试某型号汽车在冷启动(冷启动指发动机水温低的情况下启动)时催化装置内CO和NO百分含量随时间变化曲线如图3所示.则前10s 内,CO和NO百分含量没明显变化的原因是尚未达到催化剂工作温度(或尚未达到反应的温度).
③研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了以下三组实验:
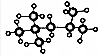
根据坐标图4,计算400K时该反应的平衡常数为5000L•mol-1;并在图中画出上表中的实验Ⅱ、Ⅲ条件下混合气体中NO浓度随时间变化的趋势曲线图(标明各条曲线的实验编号).

(1)汽车发动机工作时会引发N2(g)+O2(g)=2NO(g)△H=+180kJ•mol-1,其能量变化示意图如下:

则NO中氮氧键的键能为632kJ•mol-1.
(2)空燃比过小易产生CO.有人提出可以设计反应2CO(g)=2C(s)+O2(g)来消除CO的污染.判断该设想是否可行,并说出理由不合理,该反应焓增、熵减,任何条件下都不能自发进行或该反应△H>0,△S<0则△G>0.
(3)利用活性炭涂层排气管处理NOx的反应为:xC(s)+2NOx(g)?N2(g)+xCO2 (g)△H=-b kJ•mol-1.若使NOx更加有效的转化为无毒尾气排放,以下措施理论上可行的是AD.
A.增加排气管长度 B.增大尾气排放口
C.升高排气管温度 D.添加合适的催化剂
(4)催化装置中涉及的反应之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).

①探究上述反应中NO的平衡转化率与压强、温度的关系,得到图2所示的曲线.催化装置比较适合的温度和压强是400K,1MPa.
②测试某型号汽车在冷启动(冷启动指发动机水温低的情况下启动)时催化装置内CO和NO百分含量随时间变化曲线如图3所示.则前10s 内,CO和NO百分含量没明显变化的原因是尚未达到催化剂工作温度(或尚未达到反应的温度).
③研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了以下三组实验:
| 实验编号 | T(K) | NO初始浓度 (mol•L-1) | CO初始浓度 (mol•L-1) | 催化剂的比表面积(m2/g) |
| Ⅰ | 400 | 1.00×10-3 | 3.60×10-3 | 82 |
| Ⅱ | 400 | 1.00×10-3 | 3.60×10-3 | 124 |
| Ⅲ | 450 | 1.00×10-3 | 3.60×10-3 | 124 |
 ,其分子式为:C8H18,A的一氯代物有4种;A有多种同分异构体,写出其中一氯代物只有一种同分异构体的结构简式(CH3)3CC(CH3)3;
,其分子式为:C8H18,A的一氯代物有4种;A有多种同分异构体,写出其中一氯代物只有一种同分异构体的结构简式(CH3)3CC(CH3)3; 硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如图所示:
硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如图所示: