题目内容
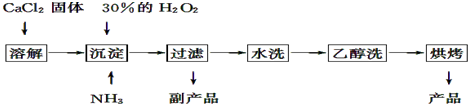
3.某学习小组用碳素钢进行了以下探究活动:[探究一](1)将已去除表面氧化膜的碳素钢钉放入冷浓硫酸中,10min后将钢钉浸入CuSO4溶液中,钢钉表面无明显变化,其原因是Fe表面被浓硫酸作用发生了钝化,生成了一层氧化物膜.
(2)称取6.0g碳素钢放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y.
①甲同学认为X中除Fe3+之外还可能含有Fe2+,若要确认是否含有Fe2+,可选用CD(选填序号).
A.KSCN溶液 B.浓氨水 C.酸性KMnO4溶液 D.K3[Fe(CN)6]溶液
②乙同学取560mL(标准状况)干燥气体Y通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得到干燥固体4.66g,由此可知Y中含硫化合物Q1的体积分数为80%.
[探究二]丙同学认为气体Y中还可能含有Q2、Q3两种气体(相同条件下Q1、Q2、Q3气体的密度依次减小).为此,设计了下列装置进行实验探究(假设有关气体完全反应).

(3)装置B中试剂的作用是确认SO2已除尽.
(4)已知洗气瓶M中盛装的是澄清石灰水,为确认Q2的存在,洗气瓶M的位置应在B与C之间,产生Q2的反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+2SO2↑+2H2O.
(5)确认含有气体Q3的实验现象是D中固体由黑变红、E中固体由白变蓝,产生Q3的反应的离子方程式为Fe+2H+═Fe2++H2↑.
分析 [探究一](1)常温下,铁易和浓硫酸发生钝化现象,从而阻止进一步反应;
(2)亚铁离子有还原性,能还原酸性高锰酸钾溶液而使其褪色,亚铁离子遇到K3[Fe(CN)6]溶液变蓝色是亚铁离子的特征性质;根据硫酸钡与二氧化硫的关系式计算二氧化硫的体积,再根据体积分数公式计算;
[探究二]称取6.0g碳素钢放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y,气体Y中还可能含有Q2、Q3两种气体(相同条件下Q1、Q2、Q3气体的密度依次减小)依据反应实质分析可知,浓硫酸和铁反应生成硫酸铁、二氧化硫和水,所含碳和浓硫酸加热反应生成二氧化碳、二氧化硫和水,随反应进行浓硫酸变为稀硫酸和铁反应生成气体为氢气,Q1、Q2、Q3气体成分为SO2、CO2、H2,依据装置通过装置A中高锰酸钾溶液除去二氧化硫,装置B中品红溶液检验二氧化硫是否除净,通过碱石灰吸收二氧化碳、水蒸气,通过装置D加热的氧化铜和氢气发生反应生成铜和水蒸气,进入装置F无水硫酸铜变蓝色,装置F是防止空气中水蒸气进入装置F影响产物检验,
(3)二氧化硫能使品红溶液褪色,据此判断是否含有二氧化硫;
(4)用澄清石灰水检验二氧化碳,首先要排除二氧化硫的干扰;碳素钢中含有碳,加热条件下,碳和浓硫酸反应生成二氧化碳;
(5)浓硫酸随反应进行浓度减小变化为稀硫酸和铁反应生成Q3为氢气;
解答 解:[探究一](1)常温下,Fe易和浓硫酸发生氧化还原反应生成致密的氧化物薄膜而阻止进一步被氧化,该现象为钝化现象,所以放入浓硫酸后的碳素钢加入硫酸铜溶液中无变化,说明Fe表面发生了钝化,生成了一层氧化物膜,
故答案为:Fe表面被浓硫酸作用发生了钝化,生成了一层氧化物膜;
(2)①亚铁离子具有还原性,而酸性高锰酸钾有氧化性,发生氧化还原反应使高锰酸钾溶液褪色,亚铁离子遇到K3[Fe(CN)6]溶液变蓝色,故选CD,
故答案为:CD;
②SO2+Br2+2H2O=2HBr+H2SO4,H2SO4+BaCl2=BaSO4↓+2HCl,所以硫酸钡和二氧化硫之间的关系式为SO2-----BaSO4,设二氧化硫的体积为V,
SO2-----BaSO4,
22.4L 233g
V 4.66g
V=0.448l=448mL,
所以二氧化硫的体积分数=$\frac{448mL}{560ml}$×100%=80%,
故答案为:80%;
[探究二]称取6.0g碳素钢放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y,气体Y中还可能含有Q2、Q3两种气体(相同条件下Q1、Q2、Q3气体的密度依次减小)依据反应实质分析可知,浓硫酸和铁反应生成硫酸铁、二氧化硫和水,所含碳和浓硫酸加热反应生成二氧化碳、二氧化硫和水,随反应进行浓硫酸变为稀硫酸和铁反应生成气体为氢气,Q1、Q2、Q3气体成分为SO2、CO2、H2,依据装置通过装置A中高锰酸钾溶液除去二氧化硫,装置B中品红溶液检验二氧化硫是否除净,通过碱石灰吸收二氧化碳、水蒸气,通过装置D加热的氧化铜和氢气发生反应生成铜和水蒸气,进入装置F无水硫酸铜变蓝色,装置F是防止空气中水蒸气进入装置F影响产物检验,
(3)二氧化硫能使品红溶液褪色,所以用品红溶液检验二氧化硫是否除尽,
故答案为:确认二氧化硫已经除尽;
(4)二氧化硫和二氧化碳都能使澄清石灰水变浑浊,但二氧化硫还能使品红溶液褪色,所以要检验二氧化碳必须排除二氧化硫的干扰,B装置是检验二氧化硫是否除尽,所以澄清石灰水应放置在B和C之间,碳素钢中含有碳,加热条件下,碳能和浓硫酸反应生成二氧化硫、二氧化碳和水,反应方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:B与C之间,C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+2SO2↑+2H2O;
(5)确认含有气体Q3为氢气的实验现象是,氢气还原氧化铜固体黑色变化为红色,生成气体中含水蒸气,遇到无水硫酸铜变蓝色,确认含有气体Q3的实验现象是D中固体由黑变红、E中固体由白变蓝,产生Q3的反应的离子方程式为Fe+2H+═Fe2++H2↑,
故答案为:D中固体由黑变红、E中固体由白变蓝,Fe+2H+═Fe2++H2↑;
点评 本题考查了浓硫酸的性质、二氧化硫的性质、常见物质的检验等知识点,注意常温下,铁和冷的浓硫酸不是不反应,而是反应生成了致密的氧化物薄膜而阻止了进一步反应,题目难度中等.

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案| 编号 | ① | ② | ③ |
| 溶液 | 0.01mol/L KHC2O4 | 0.01mol/L K2C2O4 | 溶液①与溶液②等体积混合 |
| pH | 3.1 | 8.1 | 未测定 |
| A. | ①中:c(K+)>c(HC2O4-)>c(C2O42-)>c(H+)>c(OH-) | |
| B. | ②中:c(K+)>c(C2O42-)>c(HC2O4-)>c(OH-)>c(H+) | |
| C. | ③中:c(K+)>c(HC2O4-)>c(C2O42-)>c(OH-)>c(H+) | |
| D. | ③中:2c(OH-)+c(C2O42-)=3c(H2C2O4)+c(HC2O4-)+2c(H+) |
| A. | 11.1 mol•L-1KCIO3溶液中含有的氯离子数目为NA | |
| B. | 标准状况下,22.4L H2O含有的分子数目为NA | |
| C. | 16g O2与16gO3含有的氧原子数目相等 | |
| D. | 1 mol Zn变为Zn2+时失去的电子数目为NA |
电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液(主要含Mn2+)经净化后再进行电解,MnO2在电解池的阳极析出.
90年代后期发明了生产MnO2和锌的新工艺,主要是采用软锰矿(主要成分为MnO2,含少量Al2O3和SiO2杂质)和闪锌矿(主要成分为ZnS,含少量FeS、CuS、CdS杂质)为主要原料,经过除杂后,得到含Zn2+、Mn2+离子的溶液,再通过电解同时获得MnO2和锌.简化流程框图如下(中间产物的固体部分已经略去):
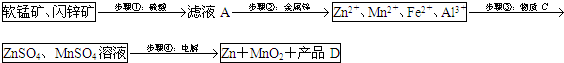
已知各种金属离子完全沉淀的pH如下表:
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
(1)步骤①中,软锰矿、闪锌矿粉与硫酸溶液共热时析出硫的反应为氧化还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,请写出MnO2在酸性溶液中分别和CuS和FeS发生反应的化学方程式:MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O、MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S↓+6H2O.
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成份为Cu、Cd(用化学符号表示)
(3)步骤③物质C由多种物质组成,其中含有两种固体,其中一种为MnO2,其作用是将Fe2+氧化为Fe3+
,另外一种固体物质可为Zn(OH)2.
(4)步骤④中电解过程中MnO2在阳极析出,该电极上发生的反应方程式为Mn2+-2e-+2H2O=MnO2+4H+
.产品D的化学式为H2SO4,该物质对整个生产的意义是用于溶解软锰矿和闪锌矿,循环使用.
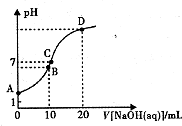 常温下,用0.1 mol/LNaOH溶液滴定10mL 0.1mol/LH2A溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列说法不正确的是( )
常温下,用0.1 mol/LNaOH溶液滴定10mL 0.1mol/LH2A溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列说法不正确的是( )| A. | A点溶液中加入少量水:$\frac{c(O{H}^{-})}{c({H}_{2}A)}$增大 | |
| B. | B点:c( HA -)>c(H+)>c(A2一)>c(H2A) | |
| C. | C点:c(Na+)=c(HA-)+2c( A2-) | |
| D. | 水电离出来的c(OH-):B点>D点 |
| A. | 7种 | B. | 6种 | C. | 5种 | D. | 4种 |
| A. | 向Ba(OH)2溶液滴加NaHSO4溶液至沉淀恰好完全:Ba 2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | 用Pt 电极电解MgCl2溶液 2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 往漂白粉溶液中通入少量SO2 Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| D. | 苯酚钠溶液与氯化铝溶液反应 3C6H5O-+Al3++3H2O═3C6H5OH+Al(OH)3↓ |
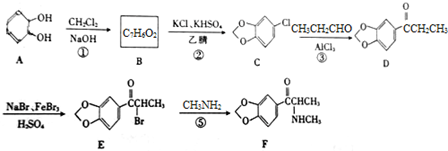
 ;
; (填结构简式);
(填结构简式); )的合成路线.
)的合成路线.