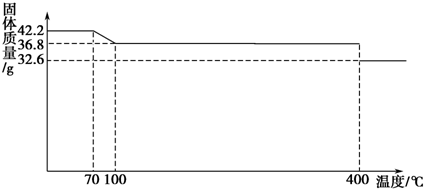
题目内容
16.某化学小组以苯甲酸为原料制取苯甲酸甲酯.已知苯甲酸25℃时的溶解度为0.35g.I.制取苯甲酸甲酯:实验装置如下:

(1)写出制取苯甲酸甲酯的化学方程式:C6H5COOH+CH3OH$\frac{\underline{\;浓硫酸\;}}{△}$C6H5COOCH3+H2O.
(2)第一步温和回流制备苯甲酸甲酯时,冷凝管的冷却水的进口为下口(填“上”或“下”),冷凝管的作用为冷凝回流,这样做的好处为提高反应物转化率或提高产率或防止反应物挥发.
(3)根据化学计量数之比,反应物甲醇应过量,其理由是提高较贵的苯甲酸的转化率.
(4)冷却后的粗产品中加入25mL水的目的是除去粗产品中混有的甲醇,将分液后的下层液体加入到1g Na2CO3中的目的是:
①吸收酯中的水并抑制酯的溶解;
②将苯甲酸转化为高沸点难挥发的苯甲酸钠.
Ⅱ.苯甲酸甲酯有多种同分异构体,其中一种同分异构体在苯环上有两个相邻侧链且与苯甲酸甲酯具有相同官能团;写出该化合物与足量NaOH溶液共热的化学方程式:
 .
.
分析 I.在加热、浓硫酸作催化剂条件下,苯甲酸和甲醇发生酯化反应生成苯甲酸甲酯;将得到的粗产品冷却,然后加入25mL水,除去产品中的甲醇;转移到分液漏斗中,摇动分液,将下层液体倒入盛有碳酸钠的锥形瓶中,碳酸钠除去苯甲酸,然后蒸馏得到苯甲酸甲酯;
(1)在加热、浓硫酸作催化剂条件下,苯甲酸和甲醇发生酯化反应生成苯甲酸甲酯;
(2)第一步温和回流制备苯甲酸甲酯时,冷凝管的冷却水要逆流而上,据此判断进水口和出水口;
冷凝管的作用是冷却蒸气,提高反应物的转化率或防止反应物挥发;
(3)一种反应物过量能增大另一种反应物的转化率;
(4)冷却后的粗产品中加入25mL水能除去粗产品中的甲醇;将分液后的下层液体加入到1g Na2CO3中,苯甲酸和碳酸钠反应生成高沸点的苯甲酸钠;且能抑制酯的溶解;
Ⅱ.苯甲酸甲酯有多种同分异构体,其中一种同分异构体在苯环上有两个相邻侧链且与苯甲酸甲酯具有相同官能团,该物质为邻甲基甲酸苯酯.
解答 解:I.在加热、浓硫酸作催化剂条件下,苯甲酸和甲醇发生酯化反应生成苯甲酸甲酯;将得到的粗产品冷却,然后加入25mL水,除去产品中的甲醇;转移到分液漏斗中,摇动分液,将下层液体倒入盛有碳酸钠的锥形瓶中,碳酸钠除去苯甲酸,然后蒸馏得到苯甲酸甲酯;
(1)在加热、浓硫酸作催化剂条件下,苯甲酸和甲醇发生酯化反应生成苯甲酸甲酯,反应方程式为C6H5COOH+CH3OH$\frac{\underline{\;浓硫酸\;}}{△}$C6H5COOCH3+H2O,
故答案为:C6H5COOH+CH3OH$\frac{\underline{\;浓硫酸\;}}{△}$C6H5COOCH3+H2O;
(2)第一步温和回流制备苯甲酸甲酯时,冷凝管的冷却水要逆流而上,所以进水口为下口;
冷凝管的作用是冷却蒸气,提高反应物转化率或提高产率或防止反应物挥发,
故答案为:下;冷凝回流;提高反应物转化率或提高产率或防止反应物挥发;
(3)一种反应物过量能增大另一种反应物的转化率,甲醇价格较低、苯甲酸价格较高,甲醇过量能增大苯甲酸转化率,故答案为:提高较贵的苯甲酸的转化率;
(4)甲醇易溶于水,所以冷却后的粗产品中加入25mL水能除去粗产品中的甲醇;将分液后的下层液体加入到1g Na2CO3中,苯甲酸和碳酸钠反应生成高沸点的苯甲酸钠,且能抑制酯的溶解,
故答案为:除去粗产品中混有的甲醇;将苯甲酸转化为高沸点难挥发的苯甲酸钠;
Ⅱ.苯甲酸甲酯有多种同分异构体,其中一种同分异构体在苯环上有两个相邻侧链且与苯甲酸甲酯具有相同官能团,该物质为邻甲基甲酸苯酯,邻甲基甲酸苯酯和氢氧化钠反应方程式为 ,
,
故答案为: .
.
点评 本题考查制备实验方案设计,为高频考点,明确实验原理是解本题关键,侧重考查实验原理、物质性质、基本操作,知道流程图中发生的反应或基本操作方法,题目难度中等.

| A. | ①中水的电离程度最小,③中水的电离程度最大 | |
| B. | 将②、③混合,若pH=7,则消耗溶液的体积②=③ | |
| C. | 将四份溶液稀释相同的倍数后,溶液的pH:③>④>②>① | |
| D. | 将①、④混合,若有c(CH3COO-)>c(H+),则混合溶液一定呈碱性 |
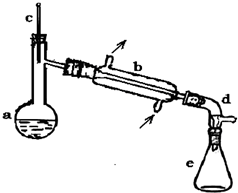 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应 和实验装置如图:
和实验装置如图:可能用到的有关数据如下:
| 相对分子质量 | 密度/(g?cm-3 ) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯11.48g.
回答下列问题:
(1)装置a的名称是蒸馏烧瓶.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).A.立即补加B.冷却后补加C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为
 .
.(4)分液漏斗在使用前检漏并须清洗干净;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(5)分离提纯过程中加入无水氯化钙的目的是干燥.
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有ACD(填正确答案标号).
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器
(7)本实验所得到的环己烯产率是70%.
| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 密度/g.cm-3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |
(1)在烧瓶中混合有机物及浓硫酸的方法是先将一定量的苯甲酸放入烧瓶中,然后再加入甲醇,最后边振荡边缓慢加入一定量的浓硫酸,试管中盛放的液体可能是Na2CO3溶液,烧瓶中反应的方程式
 ,要想提高苯甲酸的转化率,可以采取的措施是加入过量的甲醇、移去苯甲酸甲酯
,要想提高苯甲酸的转化率,可以采取的措施是加入过量的甲醇、移去苯甲酸甲酯
实验二:提纯苯甲酸甲酯
(2)停止加热,待烧瓶内的混合物冷却后,将试管及烧瓶中的液体转移到分液漏斗中,然后塞上分液漏斗的塞子再振荡后静置后,取下塞子、打开活塞,使(填主要成分的名称)苯甲酸甲酯进入锥形瓶,此时目标产物中所含杂质最多的物质是甲醇.
(3)用图C装置进行蒸馏提纯时,当温度计显示199.6 0C 时,可用锥形瓶收集苯甲酸甲酯.
实验三:探究浓硫酸在合成苯甲酸甲酯中的作用
(4)为确定浓硫酸对此反应存在催化作用,可另取等量反应物在不加浓硫酸情况下进行相同程度的加热,然后测量两个实验中的某种数据,该数据是相同时间内两个试管里生成有机层的厚度或两个试管中生成相同厚度的有机层所需的时间.