题目内容
6.某学生利用以下装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置.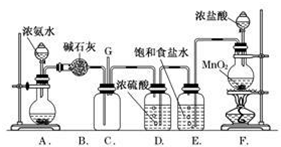
请回答下列问题:
(1)装置F中发生反应的离子方程式为MnO2+4H++2C1-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++C12↑+2H2O;
(2)E装置的作用除去氯气中混有的氯化氢气体;
(3)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一.请写出反应的化学方程式:3Cl2+8NH3═N2+6NH4Cl;
(4)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?G处接NaOH溶液的尾气处理装置.
分析 (1)实验室用二氧化锰和浓盐酸反应制备氯气,二者在加热条件下反应生成氯气、氯化锰和水;
(2)浓盐酸具有挥发性,加热能够促进盐酸的挥发制取的氯气中含有氯化氢气体,依据氯气、氯化氢溶解性解答;
(3)C内出现浓厚的白烟为氯化铵,另一生成物是空气的主要成分之一为氮气,据此写出方程式;
(4)根据氯气能够与氢氧化钠溶于反应的性质来确定尾气处理的方法.
解答 解:(1)二氧化锰和浓盐酸在加热条件下反应生成氯气、氯化锰和水,离子方程式:MnO2+4H++2C1-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++C12↑+2H2O;
故答案为:MnO2+4H++2C1-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++C12↑+2H2O;
(2)浓盐酸具有挥发性,加热能够促进盐酸的挥发制取的氯气中含有氯化氢气体,氯气在饱和食盐水中溶解度不大,氯化氢极易溶于水,所以E装置中盛放的饱和食盐水,用来除去氯气中混有的氯化氢气体;
故答案为:除去氯气中混有的氯化氢气体;
(3)C内出现浓厚的白烟为氯化铵,另一生成物是空气的主要成分之一为氮气,该反应为3Cl2+8NH3═N2+6NH4Cl,
故答案为:3Cl2+8NH3═N2+6NH4Cl;
(4)氯气是酸性气体,能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,所以可以用氢氧化钠来进行尾气处理,或者是通入装有碱石灰的干燥管或气球收集,G处接NaOH溶液的尾气处理装置;
故答案为:G处接NaOH溶液的尾气处理装置.
点评 本题考查学生实验室制取氯气、氨气的方法、干燥、性质等,熟悉氨气的制取、氯气的制取原理及物质的性质是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
14.等物质的量的氢气和氦气一定具有相同的( )
| A. | 原子数 | B. | 体积 | C. | 分子数 | D. | 质量 |
11.已知Zn(OH)2与A1(OH)3一样,是一种两性氢氧化物,它与强酸、强碱都能发生反应,但与A1(OH)3不同的是,Zn(OH)2能溶于过量的氨水中,而Al(OH)3却不能.则下面四组物质的溶液,不能运用滴加顺序进行鉴别的是( )
| A. | A1Cl3、NH3•H20 | B. | ZnCl2、NH3•H20 | C. | A1Cl3、NaOH | D. | ZnCl2、NaOH |

 .
. 某有机物结构如图,它不可能具有的性质是( )
某有机物结构如图,它不可能具有的性质是( )