题目内容
5.食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]•3H2O.42.2g K4[Fe(CN)6]•3H2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如图所示.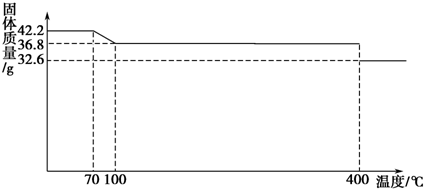
试回答下列问题:
(1)试确定150℃时固体物质的化学式K4[Fe(CN)6].
(2)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN).据此判断,烹饪食品时应注意的问题为应避免与醋、西红柿等酸性物质一起烹饪;控制烹饪温度不超过400℃.
(3)在25℃时,将a mol•L-1的KCN溶液与0.01mol•L-1的盐酸等体积混合,反应达到平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a>0.01mol•L-1(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=(100a-1)×10-7 mol•L-1.
(4)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O═2H2SO4的转化.已知,含SO2的废气通入含Fe2+、Fe3+的溶液中时,其中一个反应的离子方程式为4Fe2++O2+4H+═4Fe3++2H2O,则另一个反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
分析 (1)根据图象中数据通过计算确定150℃时固体物质的组成及化学式;
(2)与酸反应放出极毒的氰化氢(HCN)气体,400℃分解;
(3)若是等浓度,反应后生成HCN,溶液显示酸性;再根据电离常数公式求出HCN的电离常数;
(4)催化剂的特点,恢复原来状态,Fe3+→Fe2+;可以降低SO2的污染,同时制得硫酸.
解答 解:(1)K4[Fe(CN)6]•3H2O的相对分子质量为422,42.2gK4[Fe(CN)6]•3H2O的物质的量为:$\frac{42.2g}{422g/mol}$=0.1mol,0.1molK4[Fe(CN)6]•3H2O中含有0.3mol水,含有结晶水的质量为:18g/mol×0.3mol=5.4g,完全失去结晶水时的质量为:42.2g-5.4g=36.8g;根据曲线可知,100℃时K4[Fe(CN)6]•3H2O中结晶水完全失去变成K4[Fe(CN)6],之后直至加热到400℃K4[Fe(CN)6]开始分解,所以150℃时固体物质的主要成分为:K4[Fe(CN)6],
故答案为:K4[Fe(CN)6];
(2)由于“与酸反应放出极毒的氰化氢(HCN)气体”,再结合根据热重曲线,400℃分解,故应避免与醋、西红柿等酸性物质一起烹饪;控制烹饪温度不超过400℃,
故答案为:应避免与醋、西红柿等酸性物质一起烹饪;控制烹饪温度不超过400℃;
(3)KCN+HCl═KCl+HCN,若是等浓度,生成HCN应该呈酸性,而反应后PH=7呈中性,说明KCN有剩余(KCN水解呈碱性),所以a>0.01mol/L;
HCN═H++CN-Ka=c(H+)×c(CN-)/c(HCN),溶液呈中性则[H+]=10-7 mol/L,c(CN-)=$\frac{a-0.01}{2}$(等体积混合,原浓度都减半)c(HCN)=$\frac{0.01}{2}$,带入公式,Ka=10-7•(a-0.01)/0.01=(100a-1)×10-7 mol•L-1,故答案为:>;(100a-1)×10-7 mol•L-1 ;
(4)根据催化剂的特点,另一个反应一定有Fe3+→Fe2+,反应方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
点评 本题考查化学方程式有关计算、氧化还原反应、弱电解质的电离等知识点,综合性较强,明确物质性质是解本题关键,难点是(3)题计算,题目难度不大.

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是取最后一次的洗涤滤液1~2mL于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净.
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应.
①铁粉的作用是防止+2价的铁元素被氧化.
②反应结束后,无需过滤,除去过量铁粉的方法是加入适量柠檬酸让铁粉反应完全.
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体.分离过程中加入无水乙醇的目的是降低柠檬酸亚铁在水中的溶解量,有利于晶体析出.
| A. | 原子数 | B. | 体积 | C. | 分子数 | D. | 质量 |

 .
. 50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: