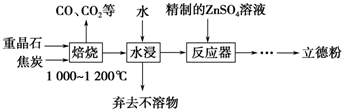
题目内容
4.将11.9g由Mg、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2.7g.另取等质量的合金溶于过量稀硝酸中,生成了6.72L NO(标准状况下),向反应后的溶液中加入过量的NaOH溶液,则最终所得沉淀的质量为( )| A. | 22.1 g | B. | 27.2 g | C. | 30 g | D. | 19.4 g |
分析 根据电子守恒计算出金属失去电子的物质的量,根据反应中金属失去电子的物质的量等于生成碱的氢氧根离子的物质的量,从金属单质转化为其氢氧化物,增加的是氢氧根离子的质量来计算生成沉淀的质量,但是不包括氢氧化铝.
解答 解:将合金溶于过量稀硝酸中,分别生成Al3+、Fe3+、Mg2+离子,根据电子守恒,金属共失去电子的物质的量和氮原子得电子的量是相等的,生成了6.72L NO,即氮原子得电子的物质的量是:$\frac{6.72L}{22.4L/mol}$×(5-2)=0.9mol,根据前后发生的整个过程的反应,知道反应中金属失去电子的物质的量等于生成碱的氢氧根离子的物质的量,即n(OH-)=0.9mol,从金属单质转化为其氢氧化物,增加的是氢氧根离子的质量,所以反应后沉淀的质量(包括氢氧化铝)等于11.9g+0.9mol×17g/mol=27.2g,但是加入过量氢氧化钠后,不会生成氢氧化铝沉淀,开始合金质量减少了2.7g,所以沉淀氢氧化铝的量是7.8g,最终所得沉淀的质量=27.2g-7.8g=19.4g,
故选D.
点评 本题考查混合物的计算,题目难度不大,注意从守恒的角度做题较为简单,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
15.下列物质属于纯净物的是( )
| A. | 苯 | B. | 天然气 | C. | 汽油 | D. | 工业酒精 |
19.下列图示与对应的叙述不相符的是( )
| A. |  图表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 | |
| B. |  图表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| C. |  图表示0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1醋酸溶液得到的滴定曲线 | |
| D. |  图是亚硫酸氢钠粉末投入稀硝酸溶液中有关图象 |
13.A、B、C为短周期元素,请根据如表信息回答问题.
①第一电离能:A<B(填“>”、“<”或“=”),基态C原子的电子排布式为1s22s22p63s23p1.
②B与C由共价键形成的某化合物BC最高可稳定到2200℃,晶体类型为原子晶体.
| 元素 | A | B | C |
| 性质或结构信息 | 工业上通过分离液态空气获得其单质,单质能助燃 | 气态氢化物的水溶液显碱性 | 原子有三个电子层,简单离子在本周期中半径最小 |
②B与C由共价键形成的某化合物BC最高可稳定到2200℃,晶体类型为原子晶体.
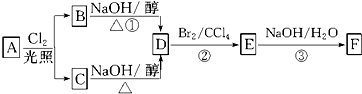
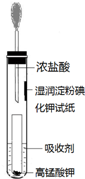
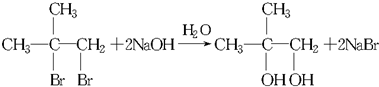 .
. 氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO K=4.5×10-4
氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO K=4.5×10-4