题目内容
下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据.
请回答:表中的金属元素是 (填字母);若A、B、C为原子序数依次增大的同周期相邻元素,表中显示B比A和C的第一电离能都略大,其原因是 .
| 电离能I(Ev) | A | B | C | D | E | F |
| I1 | 11.3 | 14.5 | 13.6 | 5.2 | 7.6 | 6.0 |
| I2 | 24.4 | 29.6 | 35.1 | 49.3 | 15.0 | 18.8 |
| I3 | 47.9 | 47.4 | 54.9 | 71.6 | 80.1 | 28.4 |
| I4 | 64.5 | 77.5 | 77.4 | 98.9 | 109.2 | 112.0 |
| I5 | 392.1 | 97.9 | 113.9 | 138.3 | 141.3 | 153.7 |
考点:元素电离能、电负性的含义及应用
专题:元素周期律与元素周期表专题
分析:原子越容易失电子,则其电离能越小,表中A、B、C第一电离能较大,应该是非金属元素,D、E、F第一电离能较小,则D、E、F应该是金属元素;
同周期相邻元素,第一电离能一般为非金属性越强,第一电离能越大,若某元素np轨道上的电子半满,不易失去一个电子,第一电离能比较大.
同周期相邻元素,第一电离能一般为非金属性越强,第一电离能越大,若某元素np轨道上的电子半满,不易失去一个电子,第一电离能比较大.
解答:
解:原子越容易失电子,则其电离能越小,金属元素的第一电离能比较小,第一个电子容易失去,表中A、B、C第一电离能较大,应该是非金属元素,D、E、F第一电离能较小,则D、E、F应该是金属元素;
若A、B、C依次为同周期相邻元素,第一电离能一般为非金属性越强,第一电离能越大,有特殊情况为,若B的np轨道上的电子半满,能量比A和C低,不易失去一个电子,故第一电离能比A和C大;
故答案为:DEF;B的np轨道上的电子半满,能量比A和C低,第一电离能比A和C大.
若A、B、C依次为同周期相邻元素,第一电离能一般为非金属性越强,第一电离能越大,有特殊情况为,若B的np轨道上的电子半满,能量比A和C低,不易失去一个电子,故第一电离能比A和C大;
故答案为:DEF;B的np轨道上的电子半满,能量比A和C低,第一电离能比A和C大.
点评:本题考查了元素的电离能,注意原子越容易失电子,则其电离能越小,侧重于基础知识的考查,题目难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
某同学在实验室中用KClO3代替MnO2制备Cl2,反应原理为KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O.下列叙述不正确的是( )
| A、氧化剂为KClO3,其中Cl元素被还原 |
| B、若有3molH2O生成,则反应中有6mol电子转移 |
| C、浓HCl在反应中起酸性和还原性的作用 |
| D、氧化剂与还原剂的物质的量之比为1:5 |
14.2g 69%的浓HNO3(密度为1.42g/cm3)与10mL 15.5mol/L HNO3的浓度相比( )
| A、是同一浓度的不同表示方法 |
| B、数值不同,也能换算为相同值 |
| C、不同浓度的两种硝酸溶液 |
| D、无法比较其大小 |
甲、乙、丙3个烧杯中分别装有稀H2SO4、CuCl2溶液、饱和食盐水,甲中电极为锌片和铜片,乙中电极为石墨棒C1、C2,丙中电极为石墨棒C3、铁片,电极之间用导线相连.则下列叙述不正确的是( )


| A、甲是化学能转变为电能,乙、丙是电能转变为化学能 |
| B、C1、C2分别是阳极、阴极,锌片、C3上都发生氧化反应 |
| C、C1和C3放出的气体相同,铜片和铁片放出的气体也相同 |
| D、甲中溶液的pH逐渐升高,乙、丙中溶液的pH逐渐减小 |
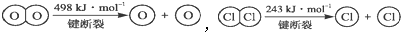 ,断开1molH-O键与断开1mol H-Cl键所需能量相差约为
,断开1molH-O键与断开1mol H-Cl键所需能量相差约为 W、Q、R、X、Y、Z六种元素的原子序数逐渐增大.已知W原子Is轨道上只有一个电子,Q、X原子p轨道的电子数分别为2和4,Z的原子序数为29,除Z外均为短周期主族元素,Y原子的价电子排布为(n+1)sn(n+1)pn.请回答下列问题:
W、Q、R、X、Y、Z六种元素的原子序数逐渐增大.已知W原子Is轨道上只有一个电子,Q、X原子p轨道的电子数分别为2和4,Z的原子序数为29,除Z外均为短周期主族元素,Y原子的价电子排布为(n+1)sn(n+1)pn.请回答下列问题: 在生产生活中,卤族元素(F、Cl、Br、I)的单质及化合物用途广泛.
在生产生活中,卤族元素(F、Cl、Br、I)的单质及化合物用途广泛.