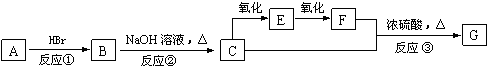
题目内容
4.用杂化理论描述CCl4的生成和分子构型.分析 CCl4中一个碳原子一个电子由2s轨道跃迁到2p轨道上杂化,再与4个Cl原子中的p电子配对成σ键,一个碳原子周围与4个氯原子相连,各原子满足8电子稳定结构,电子式为
解答 解:C所含质子数为6,原子核外电子数为6,原子核外电子排布为:1s22s22p2,Cl所含质子数为17,原子核外电子数为17,核外电子排布式为1s22s22p63s23p5,在CCl4分子中,基态C原子中已配对的2s电子拆开,一个电子由2s轨道跃迁到2p轨道上,一个2S轨道和3个2P轨道杂化,生成4个能量相等的sp3杂化轨道,再与4个Cl原子中的p电子配对成σ键,分子构型为正四面体,
故答案为:在CCl4分子中,C:2s22p2,用sp3杂化,和四个Cl的p轨道形成四个等同的σ键,分子构型为正四面体.
点评 本题考查了CCl4的生成和分子构型,掌握杂化理论是解答的关键,题目难度中等.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
14.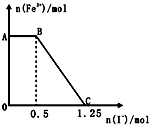 已知酸性高锰酸钾溶液可以将FeSO4氧化,化学反应的方程式为:2KMnO4+10FeSO4+8H2SO4═K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的 物质的量的变化关系如图所示,则下列有关说法不正确的是( )
已知酸性高锰酸钾溶液可以将FeSO4氧化,化学反应的方程式为:2KMnO4+10FeSO4+8H2SO4═K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的 物质的量的变化关系如图所示,则下列有关说法不正确的是( )
 已知酸性高锰酸钾溶液可以将FeSO4氧化,化学反应的方程式为:2KMnO4+10FeSO4+8H2SO4═K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的 物质的量的变化关系如图所示,则下列有关说法不正确的是( )
已知酸性高锰酸钾溶液可以将FeSO4氧化,化学反应的方程式为:2KMnO4+10FeSO4+8H2SO4═K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的 物质的量的变化关系如图所示,则下列有关说法不正确的是( )| A. | 图中AB段主要是高锰酸钾和碘化钾溶液反应 | |
| B. | 图中BC段发生的反应为2Fe3++2I-═2Fe2++I2 | |
| C. | 根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25mol | |
| D. | 向C点以后的溶液中加入少量KSCN溶液,溶液变红色 |
15.下列关于热化学反应的描述中正确的是( )
| A. | H2SO4和NaOH反应的中和热是HCl和NaOH反应的中和热的两倍 | |
| B. | CO的标准燃烧热是△H=-283.0KJ/mol,则反应2CO2(g)═2CO(g)+O2(g)的△H=+566.0KJ/mol | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 甲烷完全燃烧生成液态水和二氧化碳气体所放出的热量是甲烷的标准燃烧热 |
12.100mL 6mol•L-1的硫酸跟过量锌粒反应,在一定温度下,为了减慢反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
| A. | 碳酸钠(固体) | B. | 氨水 | C. | 碳酸氢钠溶液 | D. | 水 |
19.化学与环境、生活息息相关,下列说法错误的是( )
| A. | “光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关 | |
| B. | “雨后彩虹”“海市蜃楼”既是一种自然现象又是一种光学现象 | |
| C. | PM2.5颗粒(微粒直径约为2.5×10-6m)分散在空气中形成气溶胶 | |
| D. | 缓解旱情的措施之一是可以用干冰或碘化银进行人工降雨 |
16.下列对物质的结构组成表示正确的是( )
| A. | HClO的结构式H-Cl-O | B. | 硫离子的结构示意图 | ||
| C. | 二氧化碳的电子式 | D. | 过氧化钠的电子式 |
13.下列实验或操作过程中一定有氧化还原反应发生的是( )
| A. | 分离、提纯NaCl与KNO3混合物中的KNO3 | |
| B. | 将NaCl溶液蒸发、结晶转变为NaCl固体 | |
| C. | 用四氯化碳萃取溴水中的溴 | |
| D. | 实验室利用KMnO4与浓盐酸反应制备氯气(Cl2) |
14.许多化学反应的产物都与试剂所加的用量有关.下列与“量”有关的离子方程式中正确的是( )
| A. | 过量的NaHSO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 将少量二氧化硫气体通入次氯酸钠溶液中:SO2+2ClO-+H2O═SO32-+2HClO | |
| C. | 4mol/L的NaAlO2溶液和7mol/L的HCl等体积互相均匀混合:4AlO2-+7H++H2O═3Al(OH)3↓+Al3+ | |
| D. | FeBr2溶液中通入过量Cl2:2Fe2++2Br-+Cl2-═2Fe3++Br2+4Cl- |