题目内容
18.胶体区别于其他分散系的本质特征是( )| A. | 胶体的分散质能通过滤纸空隙,而浊液的分散质不能 | |
| B. | 胶体粒子带电荷 | |
| C. | 分散质粒子直径在1 nm~100 nm之间 | |
| D. | 产生丁达尔效应 |
分析 胶体区别于其他分散系的本质特征是分散质微粒直径的大小不同.
解答 解:胶体区别于其他分散系的本质特征是分散质微粒直径的大小不同,胶体的分散质微粒直径介于1-100nm之间.
故选C.
点评 本题考查学生教材基本知识,较简单,但较易出错,应注意三种分散系的本质区别是分散质半径大小.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
9.25℃时,测得0.01mol/L的HA、BOH两种溶液的pH值分别为3、12.取V1mL的HA溶液和V2mL的BOH溶液混合,测得混合溶液的pH值等于7.则下列定量关系判断正确的是( )
| A. | 25℃时,HA的电离平衡常数KHA=$\frac{1}{9}$ | |
| B. | 0.01mol/LBOH溶液中阳离子浓度比c(B+):c(H+)=1010:1 | |
| C. | 0.01mol/L的两溶液中水得电离度α:α(HA)=α(BOH) | |
| D. | 溶液混合时,V1=V2 |
6.一定条件下反应,现有三个容积可变恒压密闭隔热(与外界没有能量变换)容器I、Ⅱ、Ⅲ在Ⅰ中充入1molN2和3molH2.在Ⅱ中充入1molNH3,在Ⅲ中充入2molNH3.500℃条件下开始反应,达到平衡时,下列说法正确的是( )
| A. | 容器I、Ⅱ中N2物质的量关系为n(I•N2)=2n(Ⅱ•N2). | |
| B. | 容器I、Ⅱ中反应的平衡常数相同 | |
| C. | 容器I中的N2的转化率与容器Ⅱ中NH3的转化率之和小于1 | |
| D. | 容器I、Ⅲ中正反应速率相同 |
13. 高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3+3CO(g)?2Fe(s)+3CO2(g)△H=akJ•mol-1
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3+3CO(g)?2Fe(s)+3CO2(g)△H=akJ•mol-1
(1)已知:①Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol
②C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1
则 a=-28.5kJ.mol-1
(2)冶炼铁反应的平衡常数表达式K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$,温度升高后,K值减小 (填“增大“、“不变”或“减小”).
(3)在T0C时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按如表所示加人物质,反应经过一段时间后达到平衡.
①甲容器中CO的平衡转化率为60%.
②下列说法正确的是ab(填字母).
a.当容器内气体密度恒定时,表明反应达到平衡状态
b.甲容器中CO的平衡转化率小于乙容器中CO的平衡转化率
c.甲、乙容器中,CO的平衡浓度之比为3:2
d.增加Fe2O3的量可以提高CO的转化率
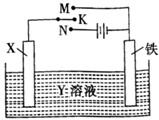
(4)采取一定措施可防止钢铁腐蚀.利用如图装置,可以模拟铁的电化学防护,其中Y为NaCl
①X为碳棒,为减缓铁的腐蚀,开关K应置N处(填字母).
②若X为锌,开关K置于M处,铁极发生的电极反应式为O2+2H2O+4e-=4OH-.
(5)高铁电池是一种新型可充电电捧,与普通高能电池相比,该电池能长时间保持稳定的放电电压,高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是AB(填字母).
A.放电时负极反应为:Zn-2e-+2OH-═Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3e-+5OH-═FeO${\;}_{4}^{2-}$+4H2O
C.放电时每转移3mol电子,正极有1molK2FeO4被氧化
D.放电时正极附近溶液的碱性减弱.
 高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3+3CO(g)?2Fe(s)+3CO2(g)△H=akJ•mol-1
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3+3CO(g)?2Fe(s)+3CO2(g)△H=akJ•mol-1(1)已知:①Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol
②C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1
则 a=-28.5kJ.mol-1
(2)冶炼铁反应的平衡常数表达式K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$,温度升高后,K值减小 (填“增大“、“不变”或“减小”).
(3)在T0C时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按如表所示加人物质,反应经过一段时间后达到平衡.
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
②下列说法正确的是ab(填字母).
a.当容器内气体密度恒定时,表明反应达到平衡状态
b.甲容器中CO的平衡转化率小于乙容器中CO的平衡转化率
c.甲、乙容器中,CO的平衡浓度之比为3:2
d.增加Fe2O3的量可以提高CO的转化率
(4)采取一定措施可防止钢铁腐蚀.利用如图装置,可以模拟铁的电化学防护,其中Y为NaCl
①X为碳棒,为减缓铁的腐蚀,开关K应置N处(填字母).
②若X为锌,开关K置于M处,铁极发生的电极反应式为O2+2H2O+4e-=4OH-.
(5)高铁电池是一种新型可充电电捧,与普通高能电池相比,该电池能长时间保持稳定的放电电压,高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是AB(填字母).
A.放电时负极反应为:Zn-2e-+2OH-═Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3e-+5OH-═FeO${\;}_{4}^{2-}$+4H2O
C.放电时每转移3mol电子,正极有1molK2FeO4被氧化
D.放电时正极附近溶液的碱性减弱.
3.下列离子方程式书写正确的是( )
| A. | 烧碱溶液中加入铝片:Al+4OH-═AlO2-+2H2O | |
| B. | 澄清石灰水与足量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O | |
| D. | 向NaAlO2溶液中通入少量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
10.H2O2水溶液俗称双氧水,医疗上利用它的杀菌消毒作用来清洗伤口.下列反应中H2O2仅体现氧化性的是( )
| A. | H2O2+Ba(OH)2═BaO2+2H2O | |
| B. | Ag2O+H2O2═2Ag+O2↑+H2O | |
| C. | 2H2O2═2H2O+O2↑ | |
| D. | 3H2O2+Cr2(SO4)3+10KOH═2K2CrO4+3K2SO4+8H2O |
7.下列物质中不属于电解质的是( )
| A. | NaOH | B. | CH4 | C. | H2SO4 | D. | KNO3 |
8.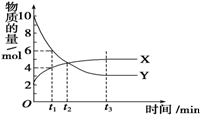 一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示,下列叙述中错误的是( )
一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示,下列叙述中错误的是( )
 一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示,下列叙述中错误的是( )
一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示,下列叙述中错误的是( )| A. | 反应的化学方程式为7Y?3X | |
| B. | t1时,Y的浓度是X浓度的1.5倍 | |
| C. | t2时,反应达到平衡状态,正、逆反应速率相等 | |
| D. | t3时,反应达到平衡状态,逆反应速率等于正反应速率 |
