题目内容
10.下列物质的用途中利用了其还原性的是( )| A. | 用葡萄糖制镜或保温瓶胆 | B. | 用Na2S除去废水中的Hg2+ | ||
| C. | Na2O2作供氧剂 | D. | SO2漂白织物 |
分析 A.葡萄糖含-CHO,可发生银镜反应;
B.生成HgS沉淀,没有元素的化合价变化;
C.Na2O2作供氧剂,与水或者二氧化碳反应生成氧气;
D.SO2漂白织物,为化合漂白,没有元素的化合价变化.
解答 解:A.葡萄糖制镜利用葡萄糖的还原性,与银氨溶液发生氧化还原反应,生成银单质,葡萄糖作还原剂被氧化,故A选;
B.用Na2S除去废水中的Hg2+,利用S2-和Hg2+反应生成难溶物HgS,为复分解反应,为非氧化还原反应,故B不选;
C.Na2O2作供氧剂,与水或者二氧化碳反应生成氧气,Na2O2既作氧化剂又作还原剂,故C不选;
D.SO2漂白织物,为化合漂白,没有元素的化合价变化,不发生氧化还原反应,与还原性无关,故D不选;
故选A.
点评 本题考查氧化还原反应,为高频考点,把握物质的性质及发生的反应为解答的关键,侧重氧化还原反应判断的考查,注意性质与用途的关系,题目难度不大

练习册系列答案
相关题目
20.下列热化学方程式中的反应热能表示燃烧热的是( )
| A. | NH3(g)+O2(g)=NO(g)+H2O(g)△H=-akJ•mol-1 | |
| B. | C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)△H=-bkJ•mol-1 | |
| C. | 2CO(g)+O2(g)=2CO2(g)△H=-ckJ•mol-1 | |
| D. | CH3CH2OH(l)+$\frac{1}{2}$O2(g)=CH3CHO(l)+H2O(l)△H=-dkJ•mol-1 |
1. 电-Fenton法是用于水体中有机污染物降解的高级氧化技术,其反应原理如图所示.其中电解产生的H2O2与Fe2+发生Fenton反应:H2O2+Fe2+═Fe3++OH-+•OH,生成的羟基自由基(•OH)能氧化降解有机污染物.下列说法中正确的是( )
电-Fenton法是用于水体中有机污染物降解的高级氧化技术,其反应原理如图所示.其中电解产生的H2O2与Fe2+发生Fenton反应:H2O2+Fe2+═Fe3++OH-+•OH,生成的羟基自由基(•OH)能氧化降解有机污染物.下列说法中正确的是( )
 电-Fenton法是用于水体中有机污染物降解的高级氧化技术,其反应原理如图所示.其中电解产生的H2O2与Fe2+发生Fenton反应:H2O2+Fe2+═Fe3++OH-+•OH,生成的羟基自由基(•OH)能氧化降解有机污染物.下列说法中正确的是( )
电-Fenton法是用于水体中有机污染物降解的高级氧化技术,其反应原理如图所示.其中电解产生的H2O2与Fe2+发生Fenton反应:H2O2+Fe2+═Fe3++OH-+•OH,生成的羟基自由基(•OH)能氧化降解有机污染物.下列说法中正确的是( )| A. | 电源的X极为正极,Y极为负极 | |
| B. | 阴极的电极反应式为Fe2+-e-═Fe3+ | |
| C. | 阳极的电极反应式为H2O-e-═H++•OH | |
| D. | 每消耗1 mol O2,整个电解池中理论上可产生2 mol•OH |
18.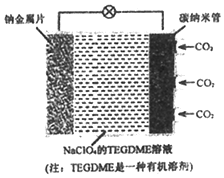 我国对‘可呼吸”的钠-二氧化碳电池的研究取得突破性进展.该电池的总反应式为:4Na+3CO2 $→_{充电}^{放电℃}$ 2Na2CO3+C,其工作原理如图所示(放电时产生Na2CO3固体储存于碳纳米管中).下列说法不正确的是( )
我国对‘可呼吸”的钠-二氧化碳电池的研究取得突破性进展.该电池的总反应式为:4Na+3CO2 $→_{充电}^{放电℃}$ 2Na2CO3+C,其工作原理如图所示(放电时产生Na2CO3固体储存于碳纳米管中).下列说法不正确的是( )
 我国对‘可呼吸”的钠-二氧化碳电池的研究取得突破性进展.该电池的总反应式为:4Na+3CO2 $→_{充电}^{放电℃}$ 2Na2CO3+C,其工作原理如图所示(放电时产生Na2CO3固体储存于碳纳米管中).下列说法不正确的是( )
我国对‘可呼吸”的钠-二氧化碳电池的研究取得突破性进展.该电池的总反应式为:4Na+3CO2 $→_{充电}^{放电℃}$ 2Na2CO3+C,其工作原理如图所示(放电时产生Na2CO3固体储存于碳纳米管中).下列说法不正确的是( )| A. | 放电时,钠金属片作负极,碳纳米管作正极 | |
| B. | 充电时,阳极反应为:2Na2CO3+C-4e-═3CO2↑+4Na+ | |
| C. | 放电时,Na+从负极区向正极区移动 | |
| D. | 该电池的电解质溶液也可使用NaClO4的水溶液 |
5.常温下,下列有关叙述正确的是( )
| A. | 在NaHA溶液中一定有:c (Na+)=c (H2A)+c (HA-)+c (A2-) | |
| B. | 能用来精确计算稀NaOH溶液中c (OH-):c (OH-)=c (NaOH)+$\frac{{K}_{W}}{c({H}^{+})}$ | |
| C. | 已知酸性:HF>CH3COOH,pH相等的NaF与CH3COOK溶液中:[c (Na+)-c (F-)]<[c (K+)-c (CH3COO-)] | |
| D. | 常温下,向5mL含有KCl和KI各为0.01mol/L的溶液中加入8mL 0.01mol/LAgNO3溶液,此时溶液中溶质的离子浓度大小关系:c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) |
15.下列项目对应的结论正确的是 ( )
| 选项 | 项目 | 结论 |
| A | 三种有机化合物:乙烷、氯乙烯、苯 | 分子内所有原子均在同一平面上 |
| B | C(CH3)4的二氯代物数目(不考虑立体异构) | 2种 |
| C | 除去乙酸乙酯中残留的乙酸 | 可用氢氧化钠溶液 |
| D | 乙醇直接转化为乙酸,油脂水解 | 均属于取代反应 |
| A. | A | B. | B | C. | C | D. | D |
2. 利用图14装置进行实验,甲、乙两池中均为1mol•L-1 CuSO4溶液,A、B均为Cu电极.实验开始先闭合K1,断开K2.一段时间后,断开K1,闭合K2,形成浓差电池,电流计指针发生偏转(Cu2+的浓度越大,其氧化性越强).下列说法错误的是( )
利用图14装置进行实验,甲、乙两池中均为1mol•L-1 CuSO4溶液,A、B均为Cu电极.实验开始先闭合K1,断开K2.一段时间后,断开K1,闭合K2,形成浓差电池,电流计指针发生偏转(Cu2+的浓度越大,其氧化性越强).下列说法错误的是( )
 利用图14装置进行实验,甲、乙两池中均为1mol•L-1 CuSO4溶液,A、B均为Cu电极.实验开始先闭合K1,断开K2.一段时间后,断开K1,闭合K2,形成浓差电池,电流计指针发生偏转(Cu2+的浓度越大,其氧化性越强).下列说法错误的是( )
利用图14装置进行实验,甲、乙两池中均为1mol•L-1 CuSO4溶液,A、B均为Cu电极.实验开始先闭合K1,断开K2.一段时间后,断开K1,闭合K2,形成浓差电池,电流计指针发生偏转(Cu2+的浓度越大,其氧化性越强).下列说法错误的是( )| A. | 闭合K1,断开K2时,电极A的质量增加 | |
| B. | 闭合K1,断开K2时,乙池溶液中c(CuSO4)逐渐增大 | |
| C. | 断开K1,闭合K2时,电极A的反应式为Cu-2e-═Cu2+ | |
| D. | 断开K1,闭合K2时,SO42-通过离子交换膜由甲池向乙池迁移 |
19.已知 A、B、C、D是短周期中原子序数依次增大的四种主族元素,A单质在常温下呈气态,B原子最外层电子数是其电子层数的2倍,C在同周期的主族元素中原子半径最大,元素D是地壳中含量最多的金属元素.下列说法正确的是( )
| A. | A、C的氧化物均含离子键 | |
| B. | C离子的半径小于D离子的半径 | |
| C. | A、B可形成多种原子个数比为1:1的化合物 | |
| D. | 含D元素的盐溶液只能显酸性 |