题目内容
2.根据要求填下列装置的序号:
(1)分离Na2CO3溶液和CH3COOC2H5(难溶于水的液体),选③,操作名称为分液.
(2)用CCl4提取碘水中的碘,选③,操作名称为萃取分液.
(3)用氢氧化钠溶液吸收CO2,选⑤,操作名称为洗气.
(4)用自来水制取纯净水,选④,操作名称为蒸馏.
分析 (1)Na2CO3溶液和CH3COOC2H5分层,分液可分离;
(2)CCl4提取碘水中的碘,为萃取法;
(3)用氢氧化钠溶液吸收CO2,为洗气;
(4)用自来水制取纯净水,水的沸点较低,利用蒸馏法制备.
解答 解:(1)分离Na2CO3溶液和CH3COOC2H5(难溶于水的液体),二者分层,选③,操作名称为分液,故答案为:③;分液;
(2)用CCl4提取碘水中的碘,碘不易溶于水,易溶于有机溶剂,选③,操作名称为萃取分液,故答案为:③;萃取分液;
(3)用氢氧化钠溶液吸收CO2,选⑤,操作名称为洗气,故答案为:⑤;洗气;
(4)用自来水制取纯净水,水的沸点较低,选④,操作名称为蒸馏,故答案为:④;蒸馏.
点评 本题考查混合物分离提纯,为高频考点,把握实验装置的作用、混合物分离方法、物质的性质为解答的关键,侧重分析与实验能力的考查,注意分离方法的选择,题目难度不大.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案
相关题目
12.乙苯催化脱氢制苯乙烯反应:
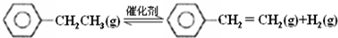
(1)已知:
计算上述反应的△H=+124 kJ•mol-1.
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=$\frac{n{α}^{2}}{(1-{α}^{2})v}$(用α等符号表示).
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应.
图1是指:在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图.请回答:
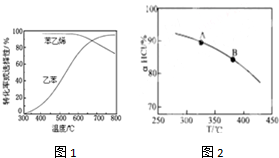
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应方向气体分子数增加,加入水蒸气起稀释,相当于起减压的效果.
②控制反应温度为600℃的理由是600℃时,乙苯的转化率和苯乙烯的选择性均较高.温度过低,反应速率慢,转化率低;温度过高,选择性下降.高温还可能使催化剂失活,且能耗大
(4)乙苯催化脱氢制苯乙烯,另一产物氢气可用于工业制HCl.而O2将HCl转化为Cl2,2HCl(g)+$\frac{1}{2}$O2(g)?H2O(g)+Cl2(g)△H<0.新型RuO2催化剂对上述HCl转化为Cl2的反应具有更好的催化活性,图1是实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的αHCl-T曲线.
①A、B两点的平衡常数K(A)与K(B)中较大的是K(A).
②在上述实验中若压缩体积使压强增大,请在图2画出相应αHCl-T曲线的示意图.
③下列措施中有利于提高αHCl的有BD.
A、增大n(HCl) B、增大n(O2) C、使用更好的催化剂 D、移去H2O.

(1)已知:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=$\frac{n{α}^{2}}{(1-{α}^{2})v}$(用α等符号表示).
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应.
图1是指:在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图.请回答:

①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应方向气体分子数增加,加入水蒸气起稀释,相当于起减压的效果.
②控制反应温度为600℃的理由是600℃时,乙苯的转化率和苯乙烯的选择性均较高.温度过低,反应速率慢,转化率低;温度过高,选择性下降.高温还可能使催化剂失活,且能耗大
(4)乙苯催化脱氢制苯乙烯,另一产物氢气可用于工业制HCl.而O2将HCl转化为Cl2,2HCl(g)+$\frac{1}{2}$O2(g)?H2O(g)+Cl2(g)△H<0.新型RuO2催化剂对上述HCl转化为Cl2的反应具有更好的催化活性,图1是实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的αHCl-T曲线.
①A、B两点的平衡常数K(A)与K(B)中较大的是K(A).
②在上述实验中若压缩体积使压强增大,请在图2画出相应αHCl-T曲线的示意图.
③下列措施中有利于提高αHCl的有BD.
A、增大n(HCl) B、增大n(O2) C、使用更好的催化剂 D、移去H2O.
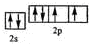 ,该元素的名称是氧;
,该元素的名称是氧;
 .
.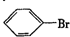 ,②
,②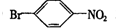 .
.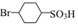 反应的化学方程式
反应的化学方程式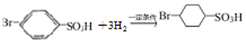 .
. ;
;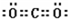 ;
;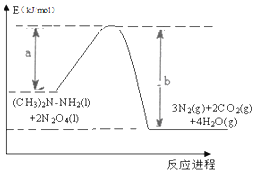 2016年10月17日上午,长征二号F型运载火箭在酒泉卫星发射中心腾空而起,成功将宇航员和“神舟十一号”飞船送入太空.火箭使用偏二甲肼【(CH3)2N-NH2】和四氧化二氮【N2 O4】作为燃料.化学反应热量变化图象如图所示:此反应的热化学方程式为:(CH3)2N-NH2(l)+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(g)△H=(a-b)KJ/mol.
2016年10月17日上午,长征二号F型运载火箭在酒泉卫星发射中心腾空而起,成功将宇航员和“神舟十一号”飞船送入太空.火箭使用偏二甲肼【(CH3)2N-NH2】和四氧化二氮【N2 O4】作为燃料.化学反应热量变化图象如图所示:此反应的热化学方程式为:(CH3)2N-NH2(l)+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(g)△H=(a-b)KJ/mol.
 铬是用途广泛的金属元素,但在生产过程中易产生有害的含铬工业废水.
铬是用途广泛的金属元素,但在生产过程中易产生有害的含铬工业废水.