题目内容
在2L密闭容器中,充入1mol N2和3mol H2,恒温恒容条件下发生合成氨反应,2min时达到平衡.测得平衡时N2的转化率为40%,求:
(1)用H2表示2min内该反应的平均反应速率
(2)NH3的平衡浓度
(3)H2在平衡混合气体中的体积分数
(4)平衡时容器的压强P平与起始时压强P始之比.
(1)用H2表示2min内该反应的平均反应速率
(2)NH3的平衡浓度
(3)H2在平衡混合气体中的体积分数
(4)平衡时容器的压强P平与起始时压强P始之比.
考点:化学平衡的计算
专题:化学平衡专题
分析:依据化学平衡的三段式列式计算得到平衡物质的量,结合平衡常数概念列式计算、体积分数为物质的量的分数,压强之比等于物质的量之比;
解答:
解:2min时达到平衡.测得平衡时N2的转化率为40%,转化的氮气为0.4mol,则
N2(g)+3H2(g)?2NH3(g)
起始(mol):1 3 0
转化(mol):0.4 1.2 0.8
平衡(mol):0.6 1.8 0.8
(1)用H2表示2min内该反应的平均反应速率=
=0.3mol/L?min,
答:用H2表示2min内该反应的平均反应速率0.3mol/L?min;
(2)NH3的平衡浓度=
=0.4 mol∕L,
答:NH3的平衡浓度为:0.4 mol∕L;
(3)H2的体积分数=
×100%=56.25%,
答:H2在平衡混合气体中的体积分数56.25%;
(4)压强之比等于物质的量之比,P平:P始=n平:n始=3.2:4=4:5,
答:平衡时容器的压强与起始时压强之比为4:5.
N2(g)+3H2(g)?2NH3(g)
起始(mol):1 3 0
转化(mol):0.4 1.2 0.8
平衡(mol):0.6 1.8 0.8
(1)用H2表示2min内该反应的平均反应速率=
| ||
| 2s |
答:用H2表示2min内该反应的平均反应速率0.3mol/L?min;
(2)NH3的平衡浓度=
| 0.8mol |
| 2L |
答:NH3的平衡浓度为:0.4 mol∕L;
(3)H2的体积分数=
| 1.8mol |
| 1.8mol+0.6mol+0.8mol |
答:H2在平衡混合气体中的体积分数56.25%;
(4)压强之比等于物质的量之比,P平:P始=n平:n始=3.2:4=4:5,
答:平衡时容器的压强与起始时压强之比为4:5.
点评:本题考查了化学平衡的三段式计算应用,主要是平衡时概念的应用,气体体积分数,压强关系是气体物质的量的关系计算,题目难度中等.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
相同状况下,下列气体所占体积最大的是( )
| A、32g SO2 |
| B、32g O2 |
| C、73gHCl |
| D、5g H2 |
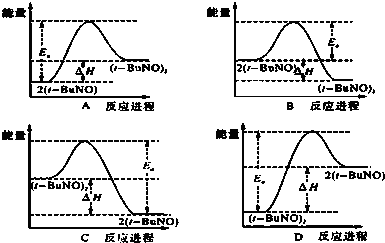

 )的路线如图所示:
)的路线如图所示: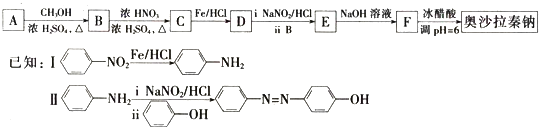
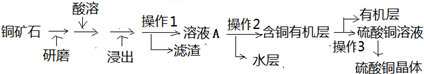
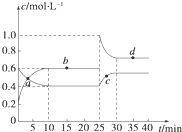 在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中发生反应:N2O4(g)??2NO2(g)△H>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示.
在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中发生反应:N2O4(g)??2NO2(g)△H>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示.