题目内容
物质(t-BuNO)2在正庚烷溶剂中发生如下反应:(t-BuNO)2?2(t-BuNO).
(1)当(t-BuNO)2的起始浓度(c0)为0.50mol/L时,实验测得20℃时的平衡转化率(α)是65%.则20℃时上述反应的平衡常数K= .(保留二位小数)
(2)一定温度下,随着(t-BuNO)2的起始浓度增大,其平衡转化率 (填“增大”、“不变”或“减小”).已知20℃时该反应在CCl4溶剂中的平衡常数为1.9,若将反应溶剂正庚烷改成CCl4,并保持(t-BuNO)2起始浓度相同,则它在CCl4溶剂中的平衡转化率 (填“大于”、“等于”或“小于”)其在正庚烷溶剂中的平衡转化率.
(3)实验测得该反应的△H=+50.5kJ/mol,活化能Ea=90.4kJ/mol.下列能量关系图合理的是 .

(4)该反应的△S 0(填“>”、“<”或“=”).在 (填“较高”或“较低”)温度下有利于该反应自发进行.
(5)通过比色分析得到30℃时(t-BuNO)2浓度随时间的变化关系如图所示,请在同一图中绘出t-BuNO浓度随时间的变化曲线.

(1)当(t-BuNO)2的起始浓度(c0)为0.50mol/L时,实验测得20℃时的平衡转化率(α)是65%.则20℃时上述反应的平衡常数K=
(2)一定温度下,随着(t-BuNO)2的起始浓度增大,其平衡转化率
(3)实验测得该反应的△H=+50.5kJ/mol,活化能Ea=90.4kJ/mol.下列能量关系图合理的是

(4)该反应的△S
(5)通过比色分析得到30℃时(t-BuNO)2浓度随时间的变化关系如图所示,请在同一图中绘出t-BuNO浓度随时间的变化曲线.

考点:化学平衡的计算,反应热和焓变,化学平衡的影响因素,物质的量或浓度随时间的变化曲线
专题:化学反应中的能量变化,化学平衡专题
分析:(1)根据化学平衡和物质的转化率,利用三段法计算各物质平衡时的浓度,再利用平衡常数的计算式来解答;
(2)由温度不变,则平衡常数不变,利用平衡常数分析起始浓度与转化率的关系;
(3)该反应的△H=50.5kJ?mol-1,则该反应为吸热反应,活化能Ea=90.4kJ?mol-1,活化能是反应物分子变为活化分子所需要的能量,再结合图象来分析;
(4)由反应来分析△S,再利用△H-T△S<0来分析有利于该反应自发进行需要的温度;
(5)由30℃时浓度随时间的变化关系图,找出不同时间(t-BuNO)2的浓度,再计算t-BuNO浓度,描点连线即得t-BuNO浓度随时间的变化曲线.
(2)由温度不变,则平衡常数不变,利用平衡常数分析起始浓度与转化率的关系;
(3)该反应的△H=50.5kJ?mol-1,则该反应为吸热反应,活化能Ea=90.4kJ?mol-1,活化能是反应物分子变为活化分子所需要的能量,再结合图象来分析;
(4)由反应来分析△S,再利用△H-T△S<0来分析有利于该反应自发进行需要的温度;
(5)由30℃时浓度随时间的变化关系图,找出不同时间(t-BuNO)2的浓度,再计算t-BuNO浓度,描点连线即得t-BuNO浓度随时间的变化曲线.
解答:
解:(1)当(t-BuNO)2的起始浓度(c0)为0.50mol?L-1时,实验测得20℃时的平衡转化率(α)是65%,
则 (t-BuNO)2?2(t-BuNO)
开始 0.5 0
转化0.5×65% 0.5×65%×2
平衡0.5×(1-65%) 0.5×65%×2
K=
=2.4(mol/L),故答案为:2.4mol/L;
(2)由三段法计算可知,K=
,温度不变,则K不变,则增大(t-BuNO)2的起始浓度为保证K不变,则转化率a应减小,20℃时该反应在CCl4溶剂中的平衡常数为1.9<2.4,保持(t-BuNO)2起始浓度相同时,由K=
,则转化率a应小于其在正庚烷溶剂中的平衡转化率;
故答案为:减小;小于;
(3)由反应的△H=50.5kJ?mol-1,则该反应为吸热反应,则反应物的总能量应小于生成物的总能量,故BC错误;
再由△H=50.5kJ?mol-1,活化能Ea=90.4kJ?mol-1,则反应热的数值大于活化能的数值的一半,故D正确,故答案为:D;
(4)由反应可知,1mol反应物参加反应时生成2mol生成物,则△S>0,再由△H-T△S<0有利于该反应自发进行,△H>0,则在较高温度下该反应能自发进行,
故答案为:>;较高;
(5)根据30℃时浓度随时间的变化关系图,找出不同时间(t-BuNO)2的浓度,再计算BuNO浓度,描点连线即得t-BuNO浓度随时间的变化曲线,如0min时,(t-BuNO)2的浓度0.05mol/L,t-BuNO浓度为0;0.5min时,(t-BuNO)2的浓度0.04mol/L,t-BuNO浓度为0.02mol/L;依次计算描点连线, ,故答案为:
,故答案为: .
.
则 (t-BuNO)2?2(t-BuNO)
开始 0.5 0
转化0.5×65% 0.5×65%×2
平衡0.5×(1-65%) 0.5×65%×2
K=
| (0.5×65%×2)2 |
| 0.5×(1-65%) |
(2)由三段法计算可知,K=
| (2coα)2 |
| c0(1-α) |
| (2coα)2 |
| c0(1-α) |
故答案为:减小;小于;
(3)由反应的△H=50.5kJ?mol-1,则该反应为吸热反应,则反应物的总能量应小于生成物的总能量,故BC错误;
再由△H=50.5kJ?mol-1,活化能Ea=90.4kJ?mol-1,则反应热的数值大于活化能的数值的一半,故D正确,故答案为:D;
(4)由反应可知,1mol反应物参加反应时生成2mol生成物,则△S>0,再由△H-T△S<0有利于该反应自发进行,△H>0,则在较高温度下该反应能自发进行,
故答案为:>;较高;
(5)根据30℃时浓度随时间的变化关系图,找出不同时间(t-BuNO)2的浓度,再计算BuNO浓度,描点连线即得t-BuNO浓度随时间的变化曲线,如0min时,(t-BuNO)2的浓度0.05mol/L,t-BuNO浓度为0;0.5min时,(t-BuNO)2的浓度0.04mol/L,t-BuNO浓度为0.02mol/L;依次计算描点连线,
 ,故答案为:
,故答案为: .
.
点评:本题考查学生利用化学平衡常数及化学平衡的三段法计算来分析解答,考查知识点较集中,注重对学生基础知识和技能的考查,并训练学生分析图象、画图象的能力,题目难度较大.

练习册系列答案
相关题目
下列化学用语正确的是( )
A、原子核内有10个中子的氧原子:
| ||
B、CCl4的电子式: | ||
C、CH4分子的比例模型: | ||
D、乙醇的结构式: |
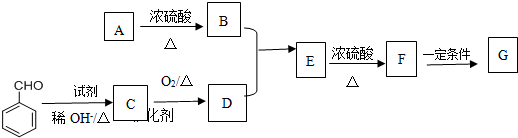
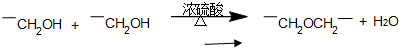
 符合如图所示关系的D有几种( )
符合如图所示关系的D有几种( )| A、1 | B、2 | C、3 | D、4 |

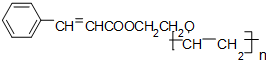
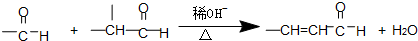
 Ⅰ甲同学向品红溶液中通入一种气体后,品红褪色.乙同学设计了一个很简单的实验便知甲同学通的是Cl2还是SO2.他的实验方案是
Ⅰ甲同学向品红溶液中通入一种气体后,品红褪色.乙同学设计了一个很简单的实验便知甲同学通的是Cl2还是SO2.他的实验方案是