题目内容
下列排列的顺序不正确的是( )
| A、离子半径:O2->Na+>Mg2+ |
| B、碱性:NaOH>Mg(OH)2>Al(OH)3 |
| C、热稳定性:HCl>PH3>H2S |
| D、结合氢离子能力:CO32->HCO3->SO42- |
考点:同一周期内元素性质的递变规律与原子结构的关系,微粒半径大小的比较
专题:
分析:A、电子层结构相同的离子,离子半径随着原子序数的增大而减小;
B、同周期从左到右金属失电子能力减弱,对应最高价氧化物对应水化物形成的碱的碱性减弱;
C、非金属性越强,则其氢化物的稳定性越强;
D、对应的酸越强,则酸根离子得到质子的能力越弱.
B、同周期从左到右金属失电子能力减弱,对应最高价氧化物对应水化物形成的碱的碱性减弱;
C、非金属性越强,则其氢化物的稳定性越强;
D、对应的酸越强,则酸根离子得到质子的能力越弱.
解答:
解:A、电子层结构相同的离子,离子半径随着原子序数的增大而减小,所以其离子半径:O2->Na+>Mg2+,故A正确;
B、同周期从左到右金属失电子能力减弱,对应最高价氧化物对应水化物形成的碱的碱性减弱,碱性:Al(OH)3<Mg(OH)2<NaOH,故B正确;
C、非金属性Cl>S>P,所以热稳定性:HCl>H2S>PH3,故C错误;
D、酸性:H2SO4>H2CO3>HCO3-,对应的酸越强,则酸根离子得到质子的能力越弱,则结合质子能力:CO32->HCO3->SO42-,故D正确.
故选C.
B、同周期从左到右金属失电子能力减弱,对应最高价氧化物对应水化物形成的碱的碱性减弱,碱性:Al(OH)3<Mg(OH)2<NaOH,故B正确;
C、非金属性Cl>S>P,所以热稳定性:HCl>H2S>PH3,故C错误;
D、酸性:H2SO4>H2CO3>HCO3-,对应的酸越强,则酸根离子得到质子的能力越弱,则结合质子能力:CO32->HCO3->SO42-,故D正确.
故选C.
点评:本题考查了离子半径大小的比较、酸性强弱的比较、结合质子能力大小的比较等知识点,难度中等,注意电离程度越小的物质,其阴离子结合质子能力越强,即水解程度越大.

练习册系列答案
相关题目
有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:(提示:NH4++OH-
NH3↑+H2O)(1)第一份加入AgNO3溶液有沉淀产生(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.下列判断正确的是( )
| ||
| A、K+不一定存在 |
| B、K+、NH4+、CO32-、SO42- 一定存在 |
| C、Cl-一定存在 |
| D、Cl-、Mg2+、Ba2+一定不存在 |
在恒温恒容密闭容器中进行的合成氨反应,下列选项一定能作为达到平衡状态标志的是( )
| A、混合气体的密度不再发生变化 |
| B、反应过程中v(N2):v(H2)=1:3 |
| C、反应过程中c(N2):c(H2):c(NH3)=1:3:2 |
| D、单位时间内断开a mol H-H键的同时断开2a mol N-H键 |
常温下在密闭容器中通入2mL某烷烃和13mL O2,点火爆炸后去掉生成的CO2和H2O,再通入6mL O2,再点火爆炸,此时O2有剩余.求烷烃的分子式和可能的结构简式.若其一卤代物有4种,命名此烷烃.
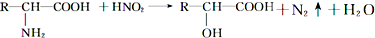 且已知:D、E的相对分子质量分别为162和144,可发生如下物质转化关系,如图所示:
且已知:D、E的相对分子质量分别为162和144,可发生如下物质转化关系,如图所示: