题目内容
3.在下列化学反应方程式中,能用离子方程式S2-+2H+=H2S↑表示的有( )①Na2S+2HCl=2NaCl+H2S↑ ②FeS+H2SO4(稀)=FeSO4+H2S↑
③ZnS+2HCl=ZnCl2+H2S↑ ④K2S+H2SO4(稀)=K2SO4+H2S↑
| A. | ①② | B. | ②③ | C. | ①④ | D. | ②④ |
分析 能用离子方程式S2-+2H+=H2S↑表示可溶性硫化物与强酸反应生成可溶性盐和H2S,以此来解答.
解答 解:ZnS、FeS不溶于水,在离子反应中均保留化学式,只有①④的离子反应可表示为S2-+2H+=H2S↑,
故选C.
点评 本题考查离子反应方程式的书写,为高频考点,把握离子反应的意义及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
相关题目
13.已知X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构.下列关于X、Y、Z、W四种元素的描述,不正确的是( )
| A. | 原子序数:Y>X>Z>W | B. | 离子半径:X+>Y2+>Z->W2- | ||
| C. | 原子最外层电子数:Z>W>Y>X | D. | 原子半径:X>Y>W>Z |
14.下列文字表述与反应方程式对应且正确的是( )
| A. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓ | |
| B. | 用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 利用腐蚀法制作印刷线路板:Fe3++Cu═Fe2++Cu2+ | |
| D. | 苯与氢气的反应: +3H2$→_{△}^{Ni}$ +3H2$→_{△}^{Ni}$ |
11.将过量的CO2分别通入①CaCl2溶液;②Na2SiO3溶液;③NaAlO2溶液;④饱和Na2CO3溶液;⑤Ca(OH)2溶液⑥Ca(ClO)2溶液.最终溶液中有沉淀或晶体析出的是( )
| A. | ①②③④⑤ | B. | ②③④ | C. | ②④⑤⑥ | D. | ①②④ |
18.下列物质中约含有6.02×1023个氯化氢分子的是( )
| A. | 365g 10%的盐酸 | B. | 22.4L 氯化氢 (已知密度为1.7g/L) | ||
| C. | 36.5g HCl气体. | D. | 0.5mol HCl气体 |
6.下列热化学方程式中,正确的是( )
| A. | 甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ 其热化学方程式为:N2(g)+3H2(g)$?_{500℃/30MPa}^{催化剂}$2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则1mol稀H2SO4和足量KOH反应的反应热为△H=2×(-57.3)kJ/mol | |
| D. | 同温同压下H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件的△H不同 |
7.实验室中区分下列各组物质的两种方法都正确的是( )
| 选项 | 需要区分的物质 | 实验方法 | |
| A | 磷酸钙和氯化铵 | 溶于水 | 与熟石灰混合研磨 |
| B | 氢氧化钠固体和熟石灰 | 将两种固体溶于水 | 溶于水,向所得溶液中分别吹入CO2气体 |
| C | 硫酸钾和碳酸钾 | 加硝酸钡溶液 | 加水溶解 |
| D | 硬水和软水 | 肥皂水 | 加热、煮沸 |
| A. | A | B. | B | C. | C | D. | D |
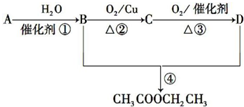 已知:①A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工发展水平;②2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
已知:①A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工发展水平;②2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.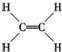 .
.