题目内容
某温度下,将Cl2通入KOH溶液中得KCl、KClO3和KClO的混合溶液.经测定ClO3-和ClO-物质的量之比为2:1,则反应中被还原的Cl2与被氧化Cl2的物质的量之比为( )
| A、2:3 | B、3:4 |
| C、11:3 | D、10:3 |
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:Cl2生成ClO-与ClO3-是被氧化的过程,Cl2生成NaCl是被还原的过程,氧化还原反应中氧化剂和还原剂之间得失电子数目相等,根据ClO-与ClO3-的物质的量浓度之比可计算失去电子的总物质的量,进而可计算得到电子的总物质的量,可计算被还原的氯元素的物质的量,则可计算被还原的氯元素和被氧化的氯元素的物质的量之比.
解答:
解:Cl2生成ClO-与ClO3-是被氧化的过程,化合价分别由0价升高为+1价和+5价,
ClO3-和ClO-物质的量之比为2:1,
则可设ClO-为1mol,ClO3-为2mol,被氧化的Cl共为3mol,
失去电子的总物质的量为1mol×(1-0)+2mol×(5-0)=11mol,
氧化还原反应中氧化剂和还原剂之间得失电子数目相等,
Cl2生成KCl是被还原的过程,化合价由0价降低为-1价,
则得到电子的物质的量也应为11mol,
则被还原的Cl的物质的量为11mol,
所以被还原的氯元素和被氧化的氯元素的物质的量之比为11mol:3mol=11:3,
故选C.
ClO3-和ClO-物质的量之比为2:1,
则可设ClO-为1mol,ClO3-为2mol,被氧化的Cl共为3mol,
失去电子的总物质的量为1mol×(1-0)+2mol×(5-0)=11mol,
氧化还原反应中氧化剂和还原剂之间得失电子数目相等,
Cl2生成KCl是被还原的过程,化合价由0价降低为-1价,
则得到电子的物质的量也应为11mol,
则被还原的Cl的物质的量为11mol,
所以被还原的氯元素和被氧化的氯元素的物质的量之比为11mol:3mol=11:3,
故选C.
点评:本题考查氧化还原反应的计算,题目难度不大,本题注意从氧化还原反应中氧化剂和还原剂之间得失电子数目相等的角度计算,注意守恒法的利用.

练习册系列答案
相关题目
以下对Cl-的叙述正确的是( )
A、结构示意图为 |
B、电子式为 |
| C、半径比K+的小 |
| D、电子数为17 |
向NaOH(aq)滴入HCOOH(aq)的过程中,所得到的混合溶液中离子浓度的大小关系可能正确的是( )
| A、c(OH-)=c(Na+)>c(HCOO-)>c(H+) |
| B、c(Na+)=c(HCOO-) |
| C、c(Na+)>c(HCOO-)>c(H+)>c(OH-) |
| D、c(H+)>c(HCOO-)>c(Na+)>c(OH-) |
将绿矾晶体加强热,除生成水蒸气以外,还发生如下反应:2FeSO4═Fe2O3+SO2↑+SO3↑,如将生成的混合气体通过BaCl2溶液,应发生的现象有( )
| A、一定产生BaSO4沉淀 |
| B、一定产生BaSO3沉淀 |
| C、一定有BaSO4沉淀 和BaSO3沉淀 |
| D、一定有SO3逸出 |
向盛有KI溶液的试管中加入一定量CCl4后,滴加少量氯水,振荡,CCl4层变成紫色,继续滴加氯水,振荡,CCl4层颜色会逐渐变浅直至无色.下列说法正确的是( )
| A、CCl4层显紫色是因为有I2生成 |
| B、溶液分两层,紫色层在上层 |
| C、CCl4层显紫色是因为有Cl2生成 |
| D、CCl4层颜色最终会变为无色因为I2会升华 |
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、标准状况下,1.8 g水中所含有氧原子数目为0.1NA |
| B、常温常压下,2.24L CO2气体中含氧原子数目为0.2NA |
| C、0.1 mol/LCuCl2溶液中,含有Cl-离子的数目为0.2NA |
| D、常温常压下,2.3 g Na+中含有的电子数为NA |
下列关于名称与化学用语表述正确的是( )
| A、乙稀:CH2=CH2 |
| B、过氧化氢:H2O |
| C、乙醇:CH3CHO |
| D、乙酸:CH3COOH |
实验室制取下列气体的实验正确的是( )
A、 实验室制氯气 |
B、 实验室制氧气 |
C、 实验室制氨气 |
D、 实验室制二氧化碳 |
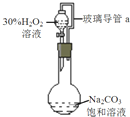 过碳酸钠是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,化学式可表示为aNa2CO3?bH2O2,具有Na2CO3和H2O2的性质.某化学兴趣小组进行如下实验:
过碳酸钠是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,化学式可表示为aNa2CO3?bH2O2,具有Na2CO3和H2O2的性质.某化学兴趣小组进行如下实验: