题目内容
将绿矾晶体加强热,除生成水蒸气以外,还发生如下反应:2FeSO4═Fe2O3+SO2↑+SO3↑,如将生成的混合气体通过BaCl2溶液,应发生的现象有( )
| A、一定产生BaSO4沉淀 |
| B、一定产生BaSO3沉淀 |
| C、一定有BaSO4沉淀 和BaSO3沉淀 |
| D、一定有SO3逸出 |
考点:二氧化硫的化学性质
专题:氧族元素
分析:混合气体中含有SO3,将生成的气体通入BaCl2溶液中发生:SO3+H2O=H2SO4,H2SO4+BaCl2=BaSO4↓+2HCl,注意H2SO3酸性小于HCl.
解答:
解:混合气体中含有SO3,将生成的气体通入BaCl2溶液中发生:SO3+H2O=H2SO4,则没有SO3逸出;
H2SO4+BaCl2=BaSO4↓+2HCl,则有BaSO4沉淀生成;
由于H2SO3酸性小于HCl和H2SO4,则SO2不能与BaCl2溶液反应而从溶液中逸出,故得不到BaSO3沉淀.
故选A.
H2SO4+BaCl2=BaSO4↓+2HCl,则有BaSO4沉淀生成;
由于H2SO3酸性小于HCl和H2SO4,则SO2不能与BaCl2溶液反应而从溶液中逸出,故得不到BaSO3沉淀.
故选A.
点评:本题考查二氧化硫的性质,为高频考点,把握SO3和SO2性质的区别,注意H2SO3酸性小于HCl和H2SO4,则不能与BaCl2溶液反应,得不到BaSO3沉淀,题目难度不大.

练习册系列答案
相关题目
一种由甲醇(CH3OH)和氧气以及氢氧化钠做电解质溶液的新型电池,其两极的电极反应式为:2CH3 OH+16OH--12e-=2CO32-+12H2O,6H2O+3O2+12e-=12OH-,关于此电池的推断正确的是( )
| A、通入氧气的一极是负极 |
| B、放电时,溶液中的OH-向正极移动 |
| C、反应中若有6mol电子发生转移,则有32g CH3 OH被还原 |
| D、该电池工作时甲醇一极附近溶液的pH降低 |
氧化还原反应的实质是电子的转移,下列关于氧化还原反应的叙述正确的是( )
| A、元素由化合态变成游离态时,它可能被氧化,也可能被还原 |
| B、11.2L Cl2通入足量的NaOH溶液中,转移的电子数为0.5NA |
| C、难失电子的原子,得电子的能力一定强 |
| D、在氧化还原反应中,有一种元素被氧化,肯定有另一种元素被还原 |
在有机物分子中能够引入羟基的反应有( )
①取代反应 ②加成反应 ③消去反应 ④氧化反应 ⑤还原反应 ⑥加聚反应.
①取代反应 ②加成反应 ③消去反应 ④氧化反应 ⑤还原反应 ⑥加聚反应.
| A、①②③④ | B、②③④⑤ |
| C、①②④⑤ | D、①②⑤⑥ |
能表示阿伏加德罗常数数值的是( )
| A、1 mol 金属钠含有的电子数 |
| B、标准状况下,22.4 L 苯所含的分子数 |
| C、0.012 kg 12C所含的原子数 |
| D、1 L 1 mol?L-1硫酸溶液所含的H+数 |
最近研究表明生命起源于火山爆发,是因为火山爆发产生的气体中含有1%的羰基硫(COS),已知羰基硫分子中所有原子的最外层都满足8电子结构,结合已学知识,判断有关说法正确的是( )
A、羰基硫的电子式为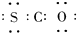 |
| B、羰基硫分子的中心原子为氧 |
| C、羰基硫中三个原子处于同一直线上 |
| D、羰基硫是非极性分子 |
某温度下,将Cl2通入KOH溶液中得KCl、KClO3和KClO的混合溶液.经测定ClO3-和ClO-物质的量之比为2:1,则反应中被还原的Cl2与被氧化Cl2的物质的量之比为( )
| A、2:3 | B、3:4 |
| C、11:3 | D、10:3 |
下列说法正确的是( )
| A、84消毒液的有效成分为次氯酸钠,起消毒作用的成分为次氯酸 |
| B、漂白粉的有效成分为次氯酸钙,是纯净物 |
| C、ClO2也可用于漂白消毒,消毒能力比氯气弱 |
| D、干燥的氯气不能使鲜花褪色 |
 如图为用惰性电极电解CuCl2溶液,并验证其产物的实验装置,回答下问题:
如图为用惰性电极电解CuCl2溶液,并验证其产物的实验装置,回答下问题: