题目内容
20.下列叙述中正确的是( )| A. | 同一主族元素原子序数越大的单质的熔点、沸点也越高 | |
| B. | 除H外,周期表中主族族序数等于周期数的元素全为金属元素 | |
| C. | 同主族的非金属的简单氢化物中最稳定的其熔、沸点也最高 | |
| D. | 同周期的主族元素形成的简单离子的半径从左到右依次减小 |
分析 A.同一主族元素原子序数越大的单质的熔点、沸点可能越高也可能越低;
B.除H外,周期表中主族族序数等于周期数的元素全为金属元素,如Be、Al等;
C.氢化物的稳定性与非金属性强弱有关,氢化物的熔沸点与相对分子质量及氢键有关;
D.同周期的主族元素形成的简单离子的半径从左到右先减小后增大再减小.
解答 解:A.同一主族元素原子序数越大的单质的熔点、沸点可能越高也可能越低,如碱金属族是随着原子序数增大而单质的熔沸点降低,卤族元素单质的熔沸点随着原子序数增大而增大,故A错误;
B.除H外,周期表中主族族序数等于周期数的元素全为金属元素,如Be、Al等都是金属元素,故B正确;
C.氢化物的稳定性与非金属性强弱有关,氢化物的熔沸点与相对分子质量及氢键有关,所以同主族的非金属的简单氢化物中最稳定的其熔、沸点不一定最高,如碳族元素中甲烷,故C错误;
D.同周期的主族元素形成的简单离子的半径从左到右先减小后增大再减小,故D错误;
故选B.
点评 本题考查同一周期、同一主族元素周期律,为高频考点,侧重考查学生分析判断能力,明确同一主族、同一周期原子结构及元素性质递变规律是解本题关键,注意规律中的反常现象,注意:氢化物的稳定性与化学键有关、氢化物的熔沸点与分子间作用力有关,知道二者的区别,为易错点.

练习册系列答案
相关题目
10.“绿色化学”是当今社会提出的一个新概念.在“绿色化学”工艺中,理想状态是反应中原子全部转化为要制取的产物,即原子利用率为100%.以下反应最符合绿色化学原子经济性要求的是( )
| A. | 乙烯发生加聚反应制得聚乙烯高分子材料 | |
| B. | 用甲烷与氯气制备一氯甲烷 | |
| C. | 用石灰石和稀盐酸反应制得二氧化碳 | |
| D. | 用苯和液溴为原料制取溴苯 |
8.氟(F)是卤素中核电荷数最小的元素,下列有关氟的说法错误的是( )
| A. | 氟的原子半径比氯的原子半径小 | B. | 氟化氢比氯化氢稳定 | ||
| C. | 氟的最高价是+7价 | D. | 氟气的氧化性比氯气的强 |
12.下列模型表示四种分子,分子中所有原子处于同一平面的是( )
| A. |  | B. |  | C. |  | D. |  |
9.下列化学用语书写正确的是( )
| A. | 用电子式表示氢溴酸的形成过程为: | |
| B. | 乙烯的结构简式:C2H4 | |
| C. | 四氯化碳的电子式为: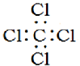 | |
| D. | 质子数为27、中子数为33的Co原子:${\;}_{27}^{60}$Co |
10.常温下pH=1的两种一元酸溶液A和B,分别加水稀释至1000倍,其pH与所加水的体积变化如图所示,则下列结论中一定正确的是( )

| A. | A酸比B酸的电离程度小 | |
| B. | A是强酸,B是弱酸 | |
| C. | pH=1时,B酸的物质的量浓度比A酸大 | |
| D. | 将pH=1的A酸和B酸稀释成pH=5的溶液,A酸所需加入的水量多 |