题目内容
10.常温下pH=1的两种一元酸溶液A和B,分别加水稀释至1000倍,其pH与所加水的体积变化如图所示,则下列结论中一定正确的是( )
| A. | A酸比B酸的电离程度小 | |
| B. | A是强酸,B是弱酸 | |
| C. | pH=1时,B酸的物质的量浓度比A酸大 | |
| D. | 将pH=1的A酸和B酸稀释成pH=5的溶液,A酸所需加入的水量多 |
分析 常温下pH=1的两种一元酸溶液A和B,分别加水稀释至1000倍,图象中A的溶液PH变化大,B溶液PH变化小,说明A溶液的酸性大于B溶液酸性,
解答 解:A.上述分析可知A酸比B酸的电离程度大,故A错误;
B.图象变化只能说明A的酸性强于B,只有a=4才能说明A为强酸,故B错误;
C.上述分析可知A酸比B酸的电离程度大,pH=1时,B酸的物质的量浓度比A酸大,故C正确;
D.将pH=1的A酸和B酸稀释成pH=5的溶液,A酸比B酸的电离程度大,B酸溶液浓度大,所以B酸所需加入的水量多,故D错误;
故选C.
点评 本题考查了弱电解质溶液稀释溶液PH变化,图象的理解应用,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
20.下列叙述中正确的是( )
| A. | 同一主族元素原子序数越大的单质的熔点、沸点也越高 | |
| B. | 除H外,周期表中主族族序数等于周期数的元素全为金属元素 | |
| C. | 同主族的非金属的简单氢化物中最稳定的其熔、沸点也最高 | |
| D. | 同周期的主族元素形成的简单离子的半径从左到右依次减小 |
1.已知aAn+,bB(n+1)+,cCn-,dD(n+1)-是具有相同的电子层结构的短周期元素形成的简单离子,下列叙述正确的是( )
| A. | 原子序数:b>a>c>d | B. | 原子半径:C>D>A>B | ||
| C. | 离子半径:Cn->D(n+1)->An+>B(n+1)+ | D. | 单质还原性:A>B>C>D |
5.运用化学反应原理研究卤族元素的有关性质具有重要意义.
(1)下列关于氯水的叙述正确的是aef(填写序号).
a.氯水中存在两种电离平衡
b.向氯水中通入SO2,其漂白性增强
c.向氯水中通入氯气,$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小
d.加水稀释氯水,溶液中的所有离子浓度均减小
e.加水稀释氯水,水的电离平衡向正反应方向移动
f.向氯水中滴加石蕊试液,先变红后褪色
(2)氯气在工业上有着极其广泛的用途.工业上通过氯碱工业生产氯气,其反应的离子方程式为2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$2OH-+Cl2↑+H2↑.用惰性电极电解100mL饱和食盐水,当阴极产生标准状况下11.2mL气体,忽略溶液体积的变化时,所得溶液的pH=12.
(3)常温下,已知25℃时有关弱酸的电离平衡常数:
写出84消毒液(主要成分为NaClO)露置在空气中发生反应的有关化学方程式NaClO+CO2+H2O═HClO+NaHCO3.若将84消毒液与洁厕剂(含有浓盐酸)混合使用可能会导致中毒,请用离子方程式解释有关原因2HClO $\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑.
(4)服用含碘化钾的碘药片可抗核辐射.将碘药片剥去糖衣皮研碎后置于试管中制得无色水溶液,并加入几滴淀粉试液,然后向试管中逐滴加入氯水,观察到溶液由无色变为蓝色,若继续滴加氯水后蓝色溶液又褪为无色.完成并配平溶液颜色由蓝色变为无色的化学反应方程式(如果系数是1,不用填写):
5Cl2+I2+6H2O→2HIO3+10HCl.
若用双氧水氧化试管中制得的无色水溶液,写出反应的离子方程式H2O2+2I-+2H+=I2+2H2O.
(1)下列关于氯水的叙述正确的是aef(填写序号).
a.氯水中存在两种电离平衡
b.向氯水中通入SO2,其漂白性增强
c.向氯水中通入氯气,$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小
d.加水稀释氯水,溶液中的所有离子浓度均减小
e.加水稀释氯水,水的电离平衡向正反应方向移动
f.向氯水中滴加石蕊试液,先变红后褪色
(2)氯气在工业上有着极其广泛的用途.工业上通过氯碱工业生产氯气,其反应的离子方程式为2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$2OH-+Cl2↑+H2↑.用惰性电极电解100mL饱和食盐水,当阴极产生标准状况下11.2mL气体,忽略溶液体积的变化时,所得溶液的pH=12.
(3)常温下,已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | HClO | H2CO3 |
| 电离平衡常数 | K=4.7×10-8 | K1=4.3×10-7,K2=5.6×10-11 |
(4)服用含碘化钾的碘药片可抗核辐射.将碘药片剥去糖衣皮研碎后置于试管中制得无色水溶液,并加入几滴淀粉试液,然后向试管中逐滴加入氯水,观察到溶液由无色变为蓝色,若继续滴加氯水后蓝色溶液又褪为无色.完成并配平溶液颜色由蓝色变为无色的化学反应方程式(如果系数是1,不用填写):
5Cl2+I2+6H2O→2HIO3+10HCl.
若用双氧水氧化试管中制得的无色水溶液,写出反应的离子方程式H2O2+2I-+2H+=I2+2H2O.
2.下列叙述正确的是( )
| A. | 铝表面易形成一层致密的氧化膜保护层,故铝可以广泛用于制造炊具和包装食品 | |
| B. | 5.6gFe在纯氧中燃烧和与足量水蒸气反应,转移电子的物质的量均为$\frac{0.8}{3}$mol | |
| C. | 金属钠在空气中燃烧得到白色固体 | |
| D. | 钠着火时,可直接用水灭火 |
11. 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如表:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如表:
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白色烟雾产生,是因为生成了HBr气体.继续滴加至液溴滴完.装置d的作用是吸收HBr和Br2;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用l0mL水、8mL l0%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是干燥;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,下列操作中必须的是C(填入正确选项前的字母);
A重结晶 B过滤 C蒸馏 D萃取
(4)在该实验中,a的容积最适合的是B(填入正确选项前的字母).
A 25mL B 50mL C 250mL D 509mL.
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如表:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如表:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白色烟雾产生,是因为生成了HBr气体.继续滴加至液溴滴完.装置d的作用是吸收HBr和Br2;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用l0mL水、8mL l0%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是干燥;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,下列操作中必须的是C(填入正确选项前的字母);
A重结晶 B过滤 C蒸馏 D萃取
(4)在该实验中,a的容积最适合的是B(填入正确选项前的字母).
A 25mL B 50mL C 250mL D 509mL.
12.下列说法中正确的是( )
| A. | 乙醇和乙二醇属于同系物 | |
| B. | 1-丁烯存在顺反异构体 | |
| C. | 将苯加入溴水中,溴水褪色,是因为发生了加成反应 | |
| D. | 分子式为C3H8与C6H14的两种有机物一定互为同系物 |
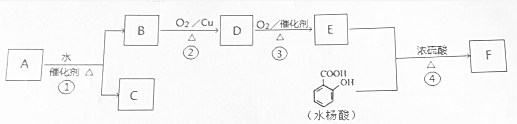
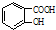 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$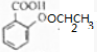 +H2O.
+H2O. +H2O.
+H2O.