题目内容
14.某溶液中只含如表离子中的几种(不考虑水的电离与离子水解),且各离子的物质的量浓度均为0.1mol/L.| 阳离子 | K+ NH4+ Fe2+ Mg2+ Al3+ Cu2+ |
| 阴离子 | OH- Cl- Al02- CO32- SiO32-SO42- |
下列说法正确的是( )
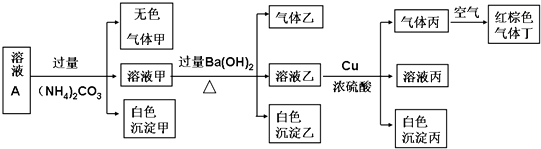
| A. | 原溶液中只含有NH4+ Fe2+Cl- SO42- | |
| B. | 由沉淀A推断原溶液中一定含有SO42- | |
| C. | 滤液A中可能含有K+ Al3+ Cl- | |
| D. | 沉淀B中一定含有Mg(OH)2 |
分析 某溶液中只含如表离子中的几种(不考虑水的电离与离子水解),且各离子的物质的量浓度均为0.1mol/L,
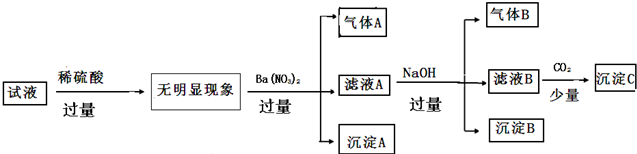
试液中加入过量稀硫酸没有明显现象,说明溶液中不含Al02-、CO32-、SiO32-,然后向溶液中加入过量硝酸钡溶液产生气体A,酸性条件下硝酸根离子具有氧化性,能氧化还原性离子,A为NO,则原溶液中含有Fe2+,则原溶液中不含OH-;
滤液A中加入过量NaOH,产生气体B,B为氨气,则原溶液中含有NH4+;
各种离子的物质的量浓度均为0.1mol•L-1,已经确定含有的阳离子为Fe2+、NH4+,而阴离子只能含有Cl-、SO42-,结合电荷守恒可知溶液中一定不存在K+、Mg2+、Al3+、Cu2+,所以沉淀B为氢氧化铁,滤液B中含有氢氧化钡,通入二氧化碳后生成了沉淀C碳酸钡,
据此分析解答.
解答 解:某溶液中只含如表离子中的几种(不考虑水的电离与离子水解),且各离子的物质的量浓度均为0.1mol/L,
试液中加入过量稀硫酸没有明显现象,说明溶液中不含Al02-、CO32-、SiO32-,然后向溶液中加入过量硝酸钡溶液产生气体A,酸性条件下硝酸根离子具有氧化性,能氧化还原性离子,A为NO,则原溶液中含有Fe2+,则原溶液中不含OH-;
滤液A中加入过量NaOH,产生气体B,B为氨气,则原溶液中含有NH4+;
各种离子的物质的量浓度均为0.1mol•L-1,已经确定含有的阳离子为Fe2+、NH4+,而阴离子只能含有Cl-、SO42-,结合电荷守恒可知溶液中一定不存在K+、Mg2+、Al3+、Cu2+,所以沉淀B为氢氧化铁,滤液B中含有氢氧化钡,通入二氧化碳后生成了沉淀C碳酸钡,
A.通过以上分析知,原溶液中只含有NH4+、Fe2+、Cl-、SO42-,故A正确;
B.由于开始时加入了稀硫酸,通过沉淀A无法判断原溶液中是否含有SO42-,故B错误;
C.滤液A中含有Cl-,但一定不存在K+、Al3+,故C错误;
D.根据分析可知,沉淀B为碳酸钡,原溶液中一定不存在镁离子,故D错误;
故选A.
点评 本题以离子检验为载体考查物质检验和鉴别,为高频考点,明确常见离子的性质为解答关键,注意掌握常见离子的检验方法及其现象,根据电荷守恒判断离子的组成情况为易错点,题目难度中等.

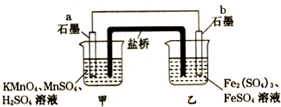 设计如图原电池(2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O),盐桥中装有饱和溶液.下列说法正确的是( )
设计如图原电池(2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O),盐桥中装有饱和溶液.下列说法正确的是( )| A. | 外电路电子的流向是从a到b | |
| B. | 电池工作时,盐桥中的SO42-移向甲烧杯 | |
| C. | a电极上发生的反应为:MnO4-+8H++5e-═Mn2++4H2O | |
| D. | 双液原电池工作时产生大量的热量 |
(1)合成氨用的氢气可以甲烷为原料制得:CH4(g)+H2O(g)?CO(g)+3H2(g).有关化学反应的能量变化如图所示.CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=+161.1kJ•mol-1.
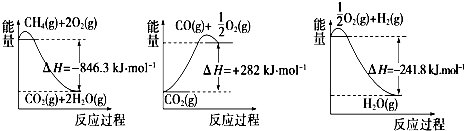
(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合铜(Ⅰ)溶液来吸收原料气中CO,其反应原理为[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)?[Cu(NH3)3]CH3COO•CO(l)△H<0.吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是B.(填字母)
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
(3)用氨气制取尿素[CO(NH2)2]的反应为2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g)△H<0.某温度下,向容积为100L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%.该温度下此反应平衡常数K的值为2500 L2•mol-2.
(4)将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵.已知弱电解质在水中的电离平衡常数(25℃)如表:现有常温下0.1mol•L-1的(NH4)2CO3溶液,
| 弱电解质 | H2CO3 | NH3•H2O |
| Ka1 | 4.30×10-7 | 1.77×10-5 |
| Ka2 | 5.61×10-11 |
②就该溶液中粒子之间有下列关系式,你认为其中不正确的是B.
A.c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3•H3O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol•L-1
D.c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
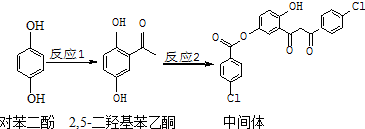
| A. | 对苯二酚在空气中能稳定存在 | |
| B. | 1 mol该中间体最多可与11 mol H2反应 | |
| C. | 2,5-二羟基苯乙酮能发生加成、取代、缩聚反应 | |
| D. | 该中间体分子中含有1个手性碳原子 |