题目内容
为测定镁带的纯度,可通过测定镁带与稀硫酸反应生成气体的体积后再进行计算.
(1)用电子天平准确称取纯净的镁带18.000g,并将其投入到足量的稀硫酸中.完全反应后,在标准状况下可收集到气体 L.
(2)若镁带中含有锌或铝中的一种杂质.现称取相同的样品进行实验,测得的气体体积(已换算到标准状况)数据列表如下:
测得气体体积的平均值是 .据此分析,测得的结果比同质量的纯镁产生的气体体积 (填“多”、“少”或“无影响”).其原因是含有杂质 (填“锌”或“铝”).
(3)利用测得的数据求镁带的纯度.
(1)用电子天平准确称取纯净的镁带18.000g,并将其投入到足量的稀硫酸中.完全反应后,在标准状况下可收集到气体
(2)若镁带中含有锌或铝中的一种杂质.现称取相同的样品进行实验,测得的气体体积(已换算到标准状况)数据列表如下:
| 实验次数 | 镁带质量(g) | 测得气体的体积(L) |
| 1 | 18.000 | 16.90 |
| 2 | 18.000 | 17.00 |
(3)利用测得的数据求镁带的纯度.
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)镁和稀硫酸反应生成氢气和硫酸镁,根据方程式Mg+H2SO4=MgSO4+H2↑进行计算;
(2)根据表中的数据可知,测得气体体积的平均值
=16.95L>16.800L,所以测得的结果比同质量的纯镁产生的气体体积多,由于2Al~3H2↑,Zn~H2↑,所以在质量相同的条件下,铝和稀硫酸反应生成的氢气比镁多,锌和稀硫酸反应生成的氢气比镁少,所以含有的杂质应该是铝;
(3)设Mg有x mol,Al有y mol,则根据固体总质量和产生的总氢气列方程组,再结合镁带的纯度=
×100%计算.
(2)根据表中的数据可知,测得气体体积的平均值
| 16.90L+17.00L |
| 2 |
(3)设Mg有x mol,Al有y mol,则根据固体总质量和产生的总氢气列方程组,再结合镁带的纯度=
| m(镁) |
| m(总质量) |
解答:
解:(1)镁和稀硫酸反应生成氢气和硫酸镁,方程式Mg+H2SO4=MgSO4+H2↑,则生成氢气的体积应该是
×22.4L/mol=16.800L,故答案为:16.800;
(2)根据表中的数据可知,测得气体体积的平均值
=16.95L>16.800L,所以测得的结果比同质量的纯镁产生的气体体积多,由于2Al~3H2↑,Zn~H2↑,所以在质量相同的条件下,铝和稀硫酸反应生成的氢气比镁多,锌和稀硫酸反应生成的氢气比镁少,所以含有的杂质应该是铝;故答案为:16.95L;多;铝;
(3)设Mg有x mol,Al有y mol,根据2Al~3H2↑,Mg~H2↑,则:
得x=0.73(mol)
所以镁带的纯度为
×100%=97.33%,
答:镁带的纯度为97.33%;
| 18.000g |
| 24g/mol |
(2)根据表中的数据可知,测得气体体积的平均值
| 16.90L+17.00L |
| 2 |
(3)设Mg有x mol,Al有y mol,根据2Al~3H2↑,Mg~H2↑,则:
|
所以镁带的纯度为
| 0.73×24 |
| 18.000 |
答:镁带的纯度为97.33%;
点评:本题是中等难度的试题,基础性强,在注重对学生基础知识巩固和训练的基础上,侧重对学生能力的培养,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和规范的答题能力,提高学生的应试能力和学习效率.

练习册系列答案
相关题目
在一密闭绝热容器中,发生放热反应:SO2(g)+NO2(g)?SO3(g)+NO(g),下列有关说法正确的是( )
| A、反应达到平衡时,降低温度,平衡逆向移动 |
| B、使用催化剂,正反应速率增大,逆反应速率减小 |
| C、若反应体系温度不再变化,说明反应达到平衡状态 |
| D、减小SO2的浓度,平衡正向移动 |
下列装置或操作合理的是( )
A、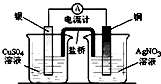 装置可将化学能转化为电能 |
B、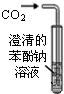 装置可用于比较碳酸、苯酚酸性的强弱 |
C、 装置可用来进行浓硫酸的稀释 |
D、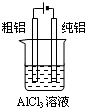 装置可用于电解精炼铝 |
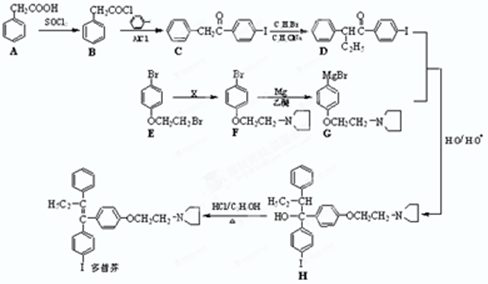
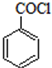 )是合成药品的重要中间体.请写出以苯、乙醚、甲醛为原料制备苯甲酰氯的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
)是合成药品的重要中间体.请写出以苯、乙醚、甲醛为原料制备苯甲酰氯的合成路线流程图(无机试剂任用).合成路线流程图示例如下: 纯碱中常含有少量氯化钠,请设计实验测定纯碱中Na2CO3的质量分数.根据你所设计的方案中的有关的数据,写出纯碱中Na2CO3的质量分数的表达式.
纯碱中常含有少量氯化钠,请设计实验测定纯碱中Na2CO3的质量分数.根据你所设计的方案中的有关的数据,写出纯碱中Na2CO3的质量分数的表达式.
 .
.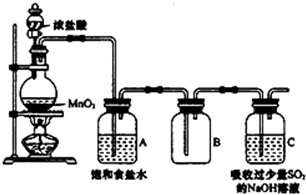 某科研小组用MnO2的浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对尾气进行吸收处理,如图所示:
某科研小组用MnO2的浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对尾气进行吸收处理,如图所示: