题目内容
12.能正确表示下列化学反应的离子方程式是( )| A. | 稀盐酸与铁粉反应:Fe+2H+=Fe2++H2↑ | |
| B. | 碳酸钡溶于醋酸:BaCO3+2H+=Ba2++H2O+CO2↑ | |
| C. | 锌片插入硝酸银溶液中:Zn+2Ag+=Zn2++2Ag | |
| D. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓ |
分析 A.二者反应生成氯化亚铁和氢气;
B.醋酸为弱酸,保留化学式;
C.二者反应生成硝酸锌和银;
D.漏掉铜离子与氢氧根离子的反应.
解答 解:A.稀盐酸与铁粉反应,离子方程式:Fe+2H+=Fe2++H2↑,故A正确;
B.碳酸钡溶于醋酸,离子方程式:BaCO3+2CH3COOH=Ba2++H2O+CO2↑+2CH3COO-,故B错误;
C.锌片插入硝酸银溶液中,离子方程式:Zn+2Ag+=Zn2++2Ag,故C正确;
D.硫酸铜溶液与氢氧化钡溶液反应,离子方程式:Cu2++2OH-+Ba2++SO42-=BaSO4↓+Cu(OH)2↓,故D错误;
故选:AC.
点评 本题考查了离子方程式书写正误判断,明确反应实质及离子方程式书写方法是解题关键,注意化学式的拆分、注意反应必须遵循客观事实,题目难度不大.

练习册系列答案
相关题目
2.下列各组物质的性质比较中,不正确的是( )
| A. | 原子半径:Na>P>O>F | B. | 稳定性:PH3<NH3<H2O<HF | ||
| C. | 碱性:KOH>NaOH>Mg(OH)2 | D. | 还原性:F->Cl->Br- |
3.为了除去括号内的杂质,其试剂选择和分离方法都正确的是( )
| 序号 | 物质(杂质) | 所用试剂 | 分离方法 |
| A | 溴苯(溴) | 苯 | 萃取分液 |
| B | 甲烷(乙烯) | 溴水 | 洗气 |
| C | 乙烯(SO2) | 酸性KMnO4 | 洗气 |
| D | 乙醇(H2O) | 生石灰 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
20.在碳酸钾中含有纯碱、硝酸钾、硝酸钡中的杂质一种或两种.将7.8g试样溶于水、得到澄清溶液,再加入过量的CaCl2溶液得到沉淀5.0g.对原样品中的杂质的判断正确的是( )
| A. | 一定没有Na2CO3和Ba(NO3)2 | |
| B. | 一定有Na2CO3而没有Ba(NO3)2 | |
| C. | 没有Ba(NO3)2但有KNO3.可能还有Na2CO3 | |
| D. | 没有Na2CO3但有Ba(NO3)2和KNO3 |
7.按化学物质分类法,下列各组物质中,依次为酸、混合物、碱的是( )
| A. | 硫酸、CuSO4•5H2O、苛性钾 | B. | 硫酸、空气、纯碱 | ||
| C. | 氧化铁、胆矾、熟石灰 | D. | 硝酸、食盐水、烧碱 |
4.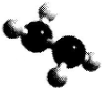 肼(N2H2)是火箭常用的高能燃料,常温下为液体,其球棍模型如图所示.肼能与双氧
肼(N2H2)是火箭常用的高能燃料,常温下为液体,其球棍模型如图所示.肼能与双氧
水发生反应:NH2+2H2O2═N2+4H2O.用NA表示阿伏伽德罗常数,下列说法正确
的是( )
 肼(N2H2)是火箭常用的高能燃料,常温下为液体,其球棍模型如图所示.肼能与双氧
肼(N2H2)是火箭常用的高能燃料,常温下为液体,其球棍模型如图所示.肼能与双氧水发生反应:NH2+2H2O2═N2+4H2O.用NA表示阿伏伽德罗常数,下列说法正确
的是( )
| A. | 标准状况下,11.2LN2中含电子总数为5 NA | |
| B. | 标准状况下,22.4LN2 H4 中所含原子总数为6 NA | |
| C. | 标准状况下,3.2gN 2H4 中含有共价键的总数为0.6 NA | |
| D. | 若生成3.6gH2 O,则上述反应转移电子的数目为0.2 NA |
2.如表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下说法正确的是( )
| 元素符号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | |
| B. | M与L形成的最高价氧化物对应水化物的碱性:L>M | |
| C. | 氢化物的稳定性为H2T<H2R | |
| D. | 单质与等浓度的稀盐酸反应的速率为Q>L |



