题目内容
20.下列电子式中,正确的是( )| A. |  | B. |  | C. |  | D. |  |
分析 A、水为共价化合物,H原子和O原子间以共价键结合;
B、HCl为共价化合物,在H原子和Cl原子间以共价键结合;
C、氯化钠为离子化合物,在钠离子和氯离子间以离子键结合;
D、氮气为单质,N原子间通过三对共用电子对结合.
解答 解:A、水为共价化合物,H原子和O原子间以共价键结合,且三个原子不在一条直线上,即电子式为 ,故A正确;
,故A正确;
B、HCl为共价化合物,在H原子和Cl原子间以共价键结合,故分子中存在一个H-Cl键,氯原子最外层达到8个电子,氯化氢正确的电子式为 ,故B错误;
,故B错误;
C、氯化钠属于离子化合物,电子式中钠离子形成离子符号形式,氯离子需要标出最外层电子,氯化钠正确的电子式为 ,故C错误;
,故C错误;
D、氮气分子中存在氮氮三键,氮原子最外层达到8电子稳定结构,氮气正确的电子式为 ,故D错误.
,故D错误.
故选A.
点评 本题考查了电子式的判断,该题是高考中的常见题型与重要的考点,该题基础性强,难易适中,主要是考查学生对常见化学用语的熟悉掌握程度,注意掌握电子式的概念及正确的表示方法.

练习册系列答案
相关题目
10.在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)?CO(g)+H2O(g)
其化学平衡常数K与温度t的关系如表:
(1)该反应的化学平衡常数表达式为K=$\frac{[CO]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]}$.
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)能判断该反应是否达到化学平衡状态的依据是ad.
a、混合气体中c(CO)不变 b、容器中压强不变
c、c(CO2)=c(CO) d、v正(H2)=v逆(H2O)
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O)试判断此时的温度为950℃.
(5)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度c(CO2)为2mol•L-1,c(H2)为1.5mol•L-1,c(CO)为1mol•L-1,c(H2O)为3mol•L-1则下一时刻,反应将逆向(填“正向”或“逆向”)进行.
CO2(g)+H2(g)?CO(g)+H2O(g)
其化学平衡常数K与温度t的关系如表:
| t℃ | 700 | 800 | 950 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)能判断该反应是否达到化学平衡状态的依据是ad.
a、混合气体中c(CO)不变 b、容器中压强不变
c、c(CO2)=c(CO) d、v正(H2)=v逆(H2O)
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O)试判断此时的温度为950℃.
(5)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度c(CO2)为2mol•L-1,c(H2)为1.5mol•L-1,c(CO)为1mol•L-1,c(H2O)为3mol•L-1则下一时刻,反应将逆向(填“正向”或“逆向”)进行.
11.下列物质中共面的碳原子数最多的是( )
| A. | 丁烷 | B. | 1,3-丁二烯 | ||
| C. | 乙苯 | D. | 2-甲基-1,3-丁二烯 |
8.下列化学用语的书写,正确的是( )
| A. | 氯气的分子式 Cl | B. | 钠原子的结构示意图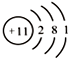 | ||
| C. | N2的电子式:N:::N: | D. | NaCl的电子式 Na+:Cl: |
15.如图所示原电池装置中,电解质溶液为硫酸,下列有关叙述错误的是( )
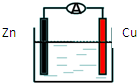

| A. | 锌做负极发生氧化反应 | |
| B. | 供电时的总反应为:Zn+2H+=Zn2++H2↑ | |
| C. | 该装置可实现化学能转化为电能 | |
| D. | 溶液中硫酸根离子向Cu极移动 |
12.羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫、线虫的危害.在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)?COS(g)+H2(g) K=0.1,反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是( )
| A. | 升高温度,H2S浓度增加,表明该反应是放热反应 | |
| B. | 通入CO后,正反应速率逐渐增大 | |
| C. | 反应前H2S物质的量为7mol | |
| D. | CO的平衡转化率为80% |
10.下列各组化合物中,化学键类型完全相同的时( )
| A. | HCl 和NaOH | B. | Na2O 和Na2O2 | C. | CaCl2 和 Na2S | D. | CO2 和 CaO |

