��Ŀ����
 ij��ɫ��Һ��ֻ�������������е�ij���֣�Na+��Mg2+��SO42-��CO32-��Cl-��MnO4-��Ϊ�˼�����Щ���ӣ��ֱ�ȡ������Һ��������ʵ�飺
ij��ɫ��Һ��ֻ�������������е�ij���֣�Na+��Mg2+��SO42-��CO32-��Cl-��MnO4-��Ϊ�˼�����Щ���ӣ��ֱ�ȡ������Һ��������ʵ�飺�ټ�ϡ�����������ɫ��ζ�����壻��������ʹ����ʯ��ˮ����ǣ�
�ڼ���������BaCl2��Һ�������ɫ���������ˣ��ڳ����м������������ᣬ����������ȫ�ܽ⣻�˳�������������Һ�м���HNO3�ữ��AgNO3��Һ��������ɫ������
��������ʵ�飬��ȷ��һ���������ӵ���
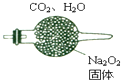
��2��200��ʱ��������Ϊ11.6g��CO2��ˮ�����Ļ��������������Na2O2��ַ�Ӧ����������������3.6g��װ����ͼ��ʾ����
��ͼ�еIJ���������������
��Na2O2��CO2��Ӧ�ķ���ʽΪ
����ԭ�������CO2��H2O�����ʵ���֮��Ϊ
���㣺�������ӵļ��鷽��,���ӹ�������
ר�⣺���ӷ�Ӧר��
��������1���ټ�ϡ�����������ɫ��ζ�����壻��������ʹ����ʯ��ˮ����ǣ���Ϊ������̼���������
�ڼ���������BaCl2��Һ�������ɫ���������ˣ��ڳ����м������������ᣬ����������ȫ�ܽ⣬������к���̼�ᱵ�����ᱵ���˳�������������Һ�м���HNO3�ữ��AgNO3��Һ��������ɫ�������˳������Ȼ�����
��2���������Ĺ���Na2O2��ͨ��11.6gCO2��H2O��������Ӧ��2Na2O2+2CO2=Na2CO3+O2��2Na2O2+2H2O=4NaOH+O2��������ֻ����3.6g������Ϊ����O2�����������غ㶨�ɿ�֪m��O2��=11.6g-3.6g=8.0g������n��O2��=
=0.25mol����������CO2��ˮ���������ʵ����ֱ�ΪΪxmol��ymol�������������������ʵ���������֮�ͣ��з��̼��㣮
�ڼ���������BaCl2��Һ�������ɫ���������ˣ��ڳ����м������������ᣬ����������ȫ�ܽ⣬������к���̼�ᱵ�����ᱵ���˳�������������Һ�м���HNO3�ữ��AgNO3��Һ��������ɫ�������˳������Ȼ�����
��2���������Ĺ���Na2O2��ͨ��11.6gCO2��H2O��������Ӧ��2Na2O2+2CO2=Na2CO3+O2��2Na2O2+2H2O=4NaOH+O2��������ֻ����3.6g������Ϊ����O2�����������غ㶨�ɿ�֪m��O2��=11.6g-3.6g=8.0g������n��O2��=
| 8g |
| 32g/mol |
���
�⣺��1������Һ����ɫ�ģ�һ��������MnO4-��
�ټ�ϡ�����������ɫ��ζ�����壻��������ʹ����ʯ��ˮ����ǣ���Ϊ������̼���������һ������CO32-��Mg2+��CO32-�����棬����һ��û��Mg2+��
�ڼ���������BaCl2��Һ�������ɫ���������ˣ��ڳ����м������������ᣬ����������ȫ�ܽ⣬������к���̼�ᱵ�����ᱵ����Һ��һ������CO32-��SO42-���˳�������������Һ�м���HNO3�ữ��AgNO3��Һ��������ɫ�������˳������Ȼ����������������Ƿ���ڲ�һ������Ϊ�Ȼ����к��������ӣ���Һ��ʾ���ԣ�����ֻ���������ӣ�Ӧ�ú��������ӣ�
�ʴ�Ϊ��Na+��CO32-��SO42-��Mg2+��MnO4-��Cl-��
��2���ٸ�װ�õ������Ǹ���ܣ��ʴ�Ϊ������ܣ�
�ڹ��������ܺͶ�����̼֮�䷴Ӧ����̼���ƺ���������Ӧ����ʽΪ��2Na2O2+2CO2=Na2CO3+O2���ʴ�Ϊ��2Na2O2+2CO2=Na2CO3+O2��
�۽⣺�������Ĺ���Na2O2��ͨ��11.6gCO2��H2O������ֻ����3.6g������Ϊ����O2�����������غ㶨�ɿ�֪m��O2��=11.6g-3.6g=8.0g������n��O2��=
=0.25mol��
��������CO2��ˮ���������ʵ����ֱ�ΪΪxmol��ymol����
2Na2O2+2CO2=Na2CO3+O2��
xmol 0.5xmol
2Na2O2+2H2O=4NaOH+O2��
ymol 0.5ymol
����0.5x+0.5y=0.25��44x+18y=11.6����ã�x=0.1��y=0.4����ԭ�������CO2��H2O�����ʵ�����Ϊ0.1mol��0.4mol=1��4��
�ʴ�Ϊ��1��4��
�ټ�ϡ�����������ɫ��ζ�����壻��������ʹ����ʯ��ˮ����ǣ���Ϊ������̼���������һ������CO32-��Mg2+��CO32-�����棬����һ��û��Mg2+��
�ڼ���������BaCl2��Һ�������ɫ���������ˣ��ڳ����м������������ᣬ����������ȫ�ܽ⣬������к���̼�ᱵ�����ᱵ����Һ��һ������CO32-��SO42-���˳�������������Һ�м���HNO3�ữ��AgNO3��Һ��������ɫ�������˳������Ȼ����������������Ƿ���ڲ�һ������Ϊ�Ȼ����к��������ӣ���Һ��ʾ���ԣ�����ֻ���������ӣ�Ӧ�ú��������ӣ�
�ʴ�Ϊ��Na+��CO32-��SO42-��Mg2+��MnO4-��Cl-��
��2���ٸ�װ�õ������Ǹ���ܣ��ʴ�Ϊ������ܣ�
�ڹ��������ܺͶ�����̼֮�䷴Ӧ����̼���ƺ���������Ӧ����ʽΪ��2Na2O2+2CO2=Na2CO3+O2���ʴ�Ϊ��2Na2O2+2CO2=Na2CO3+O2��
�۽⣺�������Ĺ���Na2O2��ͨ��11.6gCO2��H2O������ֻ����3.6g������Ϊ����O2�����������غ㶨�ɿ�֪m��O2��=11.6g-3.6g=8.0g������n��O2��=
| 8g |
| 32g/mol |
��������CO2��ˮ���������ʵ����ֱ�ΪΪxmol��ymol����
2Na2O2+2CO2=Na2CO3+O2��
xmol 0.5xmol
2Na2O2+2H2O=4NaOH+O2��
ymol 0.5ymol
����0.5x+0.5y=0.25��44x+18y=11.6����ã�x=0.1��y=0.4����ԭ�������CO2��H2O�����ʵ�����Ϊ0.1mol��0.4mol=1��4��
�ʴ�Ϊ��1��4��
���������⿼�����ӵļ��顢�������йؼ��㡢�������Ƶ����ʵȣ�ע��������������仯��ԭ���ݷ�Ӧ�ķ���ʽ���㣬�Ѷ��еȣ�

��ϰ��ϵ�д�
�����Ŀ
����ʵ����ʵ�в���˵��NH3?H2O��������ʵ��ǣ�������
| A����ˮ��Һ����̪��Һ��� |
| B��������0.1mol/L��ˮ��ҺpH=11 |
| C��NH4Cl��Һ������ |
| D��NH3?H2Oֻ�ܲ��ֵ������NH4+��OH- |
����ͬ�¶��£��������ͬ�������ܱ������ڳ����������CO2��SO2���壬������˵����ȷ���ǣ�������
| A��CO2��SO2�����ʵ�����Ϊ1��1 |
| B��CO2��SO2���ܶȱ�Ϊ1��1 |
| C��CO2��SO2�����ʵ���Ũ�ȱ�Ϊ11��16 |
| D��CO2��SO2��������ԭ�Ӹ�����Ϊ16��11 |