题目内容
8.硫酸亚铁铵[(NH4)2Fe(SO4)2•6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁.硫酸亚铁铵在 500℃时隔绝空气加热完全分解.回答下列问题: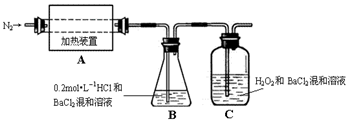
(1)硫酸亚铁铵隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和SO2.
(2)为检验分解产物的成份,设计如图实验装置进行实验,加热A中的硫酸亚铁铵至分解完全.
①A中固体充分加热较长时间后,通入氮气,目的是使分解产生的气体在B、C中被吸收充分.
②为验证A中残留物是否含有FeO,需要选用的试剂有B D.
A.KSCN溶液 B.稀硫酸 C.浓盐酸 D.KMnO4溶液
③装置B中BaCl2溶液的作用是为了检验分解产物中是否有SO3气体生成,若含有该气体,观察到的现象为溶液变浑浊.
④若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为bmol,C中沉淀物质的量为amol,则b小于a(填“大于”、“小于”或“等于”)
⑤实验中,观察到C中有白色沉淀生成,则C中发生的反应为SO2+H2O2+Ba2+═BaSO4↓+2H+(用离子方程式表示).
(3)为测定某固体样品中(NH4)2Fe(SO4)2•6H2O的含量,某实验小组做了如下实验:
测定原理:MnO4-+Fe2++H+=Mn2++Fe3++H2O(方程式未配平)
测定步骤:步骤一:准确称量20.00g硫酸亚铁铵晶体,配制成100ml溶液.
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,用0.1000mol•L-1 KMnO4溶液滴定至终点,重复两次,平均消耗KMnO4溶液16.00mL.
①如何判断滴定终点?滴加最后一滴KMnO4溶液时,溶液呈微红色且半分钟不褪色,
②产品中(NH4)2Fe(SO4)2•6H2O的质量分数为62.72%.
分析 (1)氮元素和铁元素化合价升高,根据在氧化还原反应中化合价有升必有降,化合价降低的应该是硫,所以气体产物中还可能有SO2;
(2)①A中固体充分加热较长时间后,通入氮气目的是使分解生成的气体在BC装置中完全吸收;
②为验证A中残留物是否含有FeO,应该先用稀硫酸溶解,然后再用KMnO4溶液检验亚铁离子;
③装置B中BaC12溶液的作用是为了检验分解产物中是否有SO3气体生成,若含有该气体,会生成硫酸钡白色沉淀,观察到的观象为溶液变浑浊;
④若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为bmol,C中沉淀物质的量为amol,根据化合价升降必相等,硫降低的化合价(2a)等于铁升高的化合价(2b)和氮升高的化合价之和,则b小于a;
⑤C中有白色沉淀生成,是因为SO2被双氧水氧化成SO42-,SO42-再与Ba2+结合成沉淀BaSO4,则C中发生的反应为SO2+H2O2+Ba2+=BaSO4↓+2H+;
(3)①取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,用0.1000mol•L-1 KMnO4溶液滴定,到滴入最后一滴高锰酸钾溶液至紫红色且半分钟不变,说明反应至终点;
②结合化学反应定量关系计算,MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O.
解答 解:(1)氮元素和铁元素化合价升高,根据在氧化还原反应中化合价有升必有降,化合价降低的应该是硫,所以气体产物中还可能有SO2;
故答案为:SO2;
(2)①A中固体充分加热较长时间后,通入氮气目的是使分解生成的气体在BC装置中完全吸收;
故答案为:使分解产生的气体在B、C中被吸收充分;
②为验证A中残留物是否含有FeO,应该先用稀硫酸溶解,然后再用KMnO4溶液检验亚铁离子,故选BD,
故答案为:BD;
③装置B中BaC12溶液的作用是为了检验分解产物中是否有SO3气体生成,若含有该气体,会生成硫酸钡白色沉淀,观察到的观象为溶液变浑浊;
故答案为:SO3;溶液变浑浊;
④若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为bmol,C中沉淀物质的量为amol,根据化合价升降必相等,硫降低的化合价(2a)等于铁升高的化合价(2b)和氮升高的化合价之和,则b小于a,
故答案为:小于;
⑤C中有白色沉淀生成,是因为SO2被双氧水氧化成SO42-,SO42-再与Ba2+结合成沉淀BaSO4,则C中发生的反应为SO2+H2O2+Ba2+=BaSO4↓+2H,
故答案为:SO2+H2O2+Ba2+=BaSO4↓+2H+;
(3)①取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,用0.1000mol•L-1 KMnO4溶液滴定至终点,滴加最后一滴KMnO4溶液时,溶液呈微红色且半分钟不褪色,
故答案为:滴加最后一滴KMnO4溶液时,溶液呈微红色且半分钟不褪色;
②MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
1 5
0.01600L×0.1000mol•L-1 n
n=0.008mol,
100ml溶液中含亚铁离子物质的量=0.008mol×$\frac{100}{25}$=0.032mol,
产品中(NH4)2Fe(SO4)2•6H2O的质量分数=$\frac{0.032mol×392g/mol}{20.00g}$×100%=62.72%,
故答案为:62.72%.
点评 本题考查了物质性质的实验探究和实验设计,注意氧化还原反应和盐类水解等知识的灵活应用,注意分析题干信息和定量计算,题目难度中等.

| A. | A的单质的熔点最高 | B. | B元素的非金属性最强 | ||
| C. | C的简单离子半径最小 | D. | D的原子半径最大 |
| A. | Fe | B. | 胆矾 | C. | 含酚酞的碱溶液 | D. | pH试纸 |
| A. | Cl2 和水反应:Cl2+H2O?2H++Cl-+ClO- | |
| B. | 硫酸铜溶液与氢氧化钡反应:SO42-+Ba2+═BaSO4↓ | |
| C. | 氯化亚铁溶液中通足量Cl2: Cl2+Fe2+═Fe3++2Cl- | |
| D. | 碳酸氢钙溶液和少量的澄淸石灰水混合:HCO3-+Ca2++OH-═CaCO3↓+H2O |
| A. | K2S | B. | MgF2 | C. | MgS | D. | NaF |
| A. | 14462Sm与15062Sm互为同位素 | |
| B. | 14462Sm与15062Sm互为同分异构体 | |
| C. | 14462Sm与15062Sm是同一种核素 | |
| D. | 14462Sm与15062Sm的核外电子数和中子数均为62 |
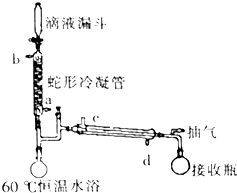 过氧乙酸是高效、速效、广谱灭菌剂.实验室合成与含量测定的相关步骤如下:
过氧乙酸是高效、速效、广谱灭菌剂.实验室合成与含量测定的相关步骤如下: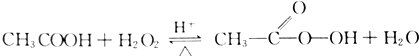 ,向装有搅拌装置及温度计的500ml三口烧瓶中先加入16.0g冰醋酸,然后在搅拌下滴加90g浓缩后的H2O2溶液,最后加入7.5ml浓硫酸,搅拌下加热5h,静置20h.
,向装有搅拌装置及温度计的500ml三口烧瓶中先加入16.0g冰醋酸,然后在搅拌下滴加90g浓缩后的H2O2溶液,最后加入7.5ml浓硫酸,搅拌下加热5h,静置20h.
 .
.