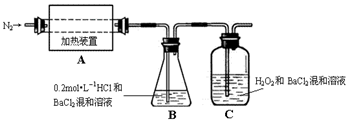
题目内容
10.A、B、C、D是原子序数依次増大为2的短周期元素,它们分布在两个周期内,其中两种是金属元素,B的原子半径最小.下列叙述正确的是( )| A. | A的单质的熔点最高 | B. | B元素的非金属性最强 | ||
| C. | C的简单离子半径最小 | D. | D的原子半径最大 |
分析 A、B、C、D是原子序数依次増大为2的短周期元素,它们分布在两个周期内,其中两种是金属元素,则A、B位于第二周期,C、D位于第三周期,B的原子半径最小,B为F,结合原子序数可知,A为N,C为Na,D为Al,以此来解答.
解答 解:由上述分析可知,A为N,B为F,C为Na,D为Al,
A.固态金属单质的熔点大于气态非金属单质的熔点,且金属的离子半径越小、电荷越大,溶液越大,即Al的熔点最高,故A错误;
B.同周期从左向右非金属性增强,同主族从上到下非金属性减弱,则F的非金属性最强,故B正确;
C.电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小,则D的简单离子半径最小,故C错误;
D.电子层越多,原子半径越大,同周期从左向右原子半径减小,则C的原子半径最大,故D错误;
故选B.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、原子序数关系为解答的关键,侧重分析与应用能力的考查,注意B为F是元素推断的突破口及规律性知识的应用,题目难度中等.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
15.下列说法不正确的是( )
| A. | 铁粉表面的油污用热的纯碱溶液去油污效果更好 | |
| B. | 常温下,向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 | |
| C. | 制备无水的AlCl3、FeCl3均不能采用将溶液在空气中直接蒸干的方法 | |
| D. | 室温下,向0.1mol•L-1的HF溶液中加入水溶液显碱性的物质,HF的电离程度一定增大 |
2.下列离子方程式正确的是( )
| A. | 实验室制备氯气时用碱液吸收尾气:Cl2+OH-═Cl-+ClO-+H2O | |
| B. | 碳酸氢钠中滴加澄清石灰水:CO32-+Ca2+═CaCO3↓ | |
| C. | 大理石用盐酸溶解:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 腐蚀电路板的原理:Fe3++Cu═Fe2++Cu2+ |
 .
. .
. .
. 、
、 .
.
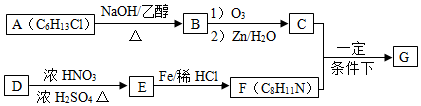
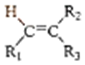 $→_{②Zn/H_{2}O}^{①O_{3}}$R1CHO+
$→_{②Zn/H_{2}O}^{①O_{3}}$R1CHO+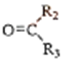
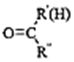 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$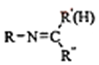 +H2O
+H2O .
. (写出其中一种的结构简式).
(写出其中一种的结构简式). $\stackrel{一定条件1}{→}$H$\stackrel{反应条件2}{→}$I$→_{一定条件}^{C}$J$\stackrel{还原}{→}$
$\stackrel{一定条件1}{→}$H$\stackrel{反应条件2}{→}$I$→_{一定条件}^{C}$J$\stackrel{还原}{→}$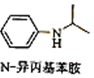

 .
. .
. .
. .
. .
.