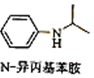
题目内容
8.下列离子方程式正确的是( )| A. | Cl2 和水反应:Cl2+H2O?2H++Cl-+ClO- | |
| B. | 硫酸铜溶液与氢氧化钡反应:SO42-+Ba2+═BaSO4↓ | |
| C. | 氯化亚铁溶液中通足量Cl2: Cl2+Fe2+═Fe3++2Cl- | |
| D. | 碳酸氢钙溶液和少量的澄淸石灰水混合:HCO3-+Ca2++OH-═CaCO3↓+H2O |
分析 A.HClO在离子反应中保留化学式;
B.漏写生成氢氧化铜的离子反应;
C.电子、电荷不守恒;
D.少量的澄淸石灰水完全反应,生成碳酸钙、水.
解答 解:A.Cl2 和水反应的离子反应为Cl2+H2O?H++Cl-+HClO,故A错误;
B.硫酸铜溶液与氢氧化钡反应的离子反应为2OH-+Cu2++SO42-+Ba2+═BaSO4↓+Cu(OH)2↓,故B错误;
C.氯化亚铁溶液中通足量Cl2的离子反应为Cl2+2Fe2+═2Fe3++2Cl-,故C错误;
D.碳酸氢钙溶液和少量的澄淸石灰水混合的离子反应为HCO3-+Ca2++OH-═CaCO3↓+H2O,故D正确;
故选D.
点评 本题考查离子反应方程式的书写,为高频考点,把握物质的性质、发生的反应、离子反应书写方法为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断及离子反应中保留化学式的物质、电荷和电子守恒,题目难度不大.

练习册系列答案
相关题目
16.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 在H2O2+Cl2═2HCl+O2反应中,每生成32g氧气,则转移4NA个电子 | |
| B. | 100g质量分数为98%的浓硫酸中所含有的氧原子数为4NA | |
| C. | NA个H2分子与NA个D2O分子的质量比为1:9 | |
| D. | 标准状况下,5.6g乙烯和丙烯的混合气体中含C-H键的数目为0.8NA |
3.下列说法不正确的是( )
| A. | 晶体硅是一种半导体材料,常用于制造光导纤维 | |
| B. | 发酵粉中含有碳酸氢钠,能使焙制出的糕点疏松多孔 | |
| C. | 铜能与氯化铁溶液反应,该反应可以应用于印刷电路板的制作 | |
| D. | 金属钠可用于冶炼钛等金属 |
1.分子式为C4H10O,属于醇的同分异构体有多少种( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
6.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 用100mL4mol•L-1盐酸与8.7gMnO2共热能制取氯气0.1NA | |
| B. | 6.0gSiO2晶体中含有的硅氧键数目为0.4NA | |
| C. | 300mL2mol•L-1酒精水溶液中所含分子数为0.6NA | |
| D. | 标准状况下,22.4L氯气参与反应时转移的电子数一定为2NA |
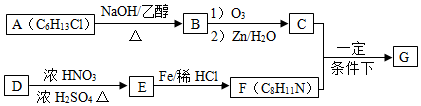
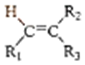 $→_{②Zn/H_{2}O}^{①O_{3}}$R1CHO+
$→_{②Zn/H_{2}O}^{①O_{3}}$R1CHO+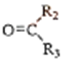
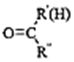 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$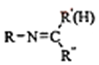 +H2O
+H2O .
. (写出其中一种的结构简式).
(写出其中一种的结构简式). $\stackrel{一定条件1}{→}$H$\stackrel{反应条件2}{→}$I$→_{一定条件}^{C}$J$\stackrel{还原}{→}$
$\stackrel{一定条件1}{→}$H$\stackrel{反应条件2}{→}$I$→_{一定条件}^{C}$J$\stackrel{还原}{→}$