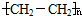题目内容
15.(1)根据价层电子对互斥模型,H3O+的空间构型为三角锥形,BCl3的空间构型为正三角形(2)按要求写出以第二周期元素为中心原子,通过SP3杂化形成中性分子的化学式(各写一种)正四面体形分子CH4或CF4,三角锥形分子NH3或NF,V形分子H2O.
分析 (1)根据价层电子对互斥理论确定VSEPR模型,去掉孤电子对后就是该微粒的立体构型;
(2)由第二周期元素为中心原子,通过sp3杂化形成中性分子,说明中心原子价层电子对是4,如果是正四面体构型,则中心原子不含孤电子对,如果呈三角锥形结构说明中心原子含有一个孤电子对,如果呈V形结构则说明中心原子含有2个孤电子对.
解答 解:(1)根据价层电子对互斥理论,H30+中价层电子对个数=3+$\frac{1}{2}$(6-1-3×1)=4,所以其VSEPR模型名称为正四面体,但有一对孤对电子对,故空间构型为三角锥形,BCl3分子中价层电子对个数=3+$\frac{1}{2}$(3-3×1)=3,且含有一个孤电子对,所以其立体结构为正三角形,故答案为:三角锥形;正三角形;
(2)由第二周期元素为中心原子,通过sp3杂化形成中性分子,说明中心原子价层电子对是4,如果是正四面体构型,则中心原子不含孤电子对,如果呈三角锥型结构说明中心原子含有一个孤电子对,如果呈V形结构则说明中心原子含有2个孤电子对,所以正四面体分子为CH4或CF4,三角锥分子为 NH3或NF3,V形分子为为H2O,故答案为:CH4或CF4;NH3或NF3;H2O.
点评 本题考查了分子或离子空间构型的判断、杂化方式的判断等知识点,根据价层电子对互斥理论来分析即可,难度中等.

练习册系列答案
相关题目
5.下列各组物质中,一定属于同系物的是( )
| A. | C2H6和C10H22 | B. | C4H6和C2H2 | C. | C3H6和C4H8 | D. | 乙二醇和丙三醇 |
6.化学式为C3H6Cl2的有机物,若再有一个氢原子被氯原子取代,则产物有两种可能的结构,原有机物的结构简式为( )
| A. | CH2Cl-CH2-CH2Cl | B. | CHCl2-CH2-CH3 | C. | CH2Cl-CHCl-CH3 | D. | CH3-CCl2-CH3 |
3.两种气态烃组成混合气体0.1mol,完全燃烧得0.16molCO2和3.6gH2O,则混合气体中( )
| A. | 混合气体中一定没有甲烷 | B. | 混合气体中一定有甲烷和乙烯 | ||
| C. | 混合气体中可能有乙烯 | D. | 混合气体中一定有乙炔和丙炔 |
10.羰基硫(COS)可用作粮食熏蒸剂,可由CO和H2S在一定条件下反应制得.在恒容的密 闭容器中发生反应并达到平衡:CO(g)+H2S(g)?COS(g)+H2(g),数据如下表所示:
下列说法正确的是( )
| 实验 | 温度/℃ | 起始时 | 平衡时 | |||
| n(CO)/mol | n(H2S)/mol | n(COS)/mol | n(H2)/mol | n(CO)/mol | ||
| 1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
| 2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | a |
| 3 | 400 | 20.0 | 20.0 | 0 | 0 | 16.0 |
| A. | 上述反应是吸热反应 | |
| B. | 实验1达平衡时,CO的转化率为70% | |
| C. | 实验2达平衡时,a<7.0 | |
| D. | 实验3达平衡后,再充入1.0 mol H2,K值增大,平衡逆向移动 |
20.下列反应中,生成物的总能量大于反应物总能量的是( )
| A. | 焦炭在高温下与水蒸气反应 | B. | 锌和稀硫酸反应制取氢气 | ||
| C. | 盐酸和氢氧化钠的中和反应 | D. | 氢气在氧气中燃烧 |
7.下列说法正确的是( )
| A. | 同主族元素的原子序数越大,其原子半径越大 | |
| B. | 在元素周期表中,元素所在的周期数等于原子核外电子数 | |
| C. | 最外层电子数为8的微粒是稀有气体元素的原子 | |
| D. | 在元素周期表中,元素所在族的族序数等于原子核外最外层电子数 |
 .
.
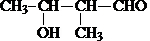
 .
. .
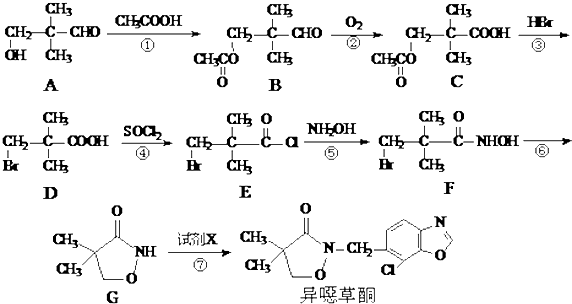
. 是B的一种重要的同分异构体.请设计合理方案,完成从
是B的一种重要的同分异构体.请设计合理方案,完成从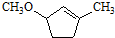 到
到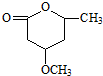 的合成路线(用合成路线流程图表示,并注明反应条件).
的合成路线(用合成路线流程图表示,并注明反应条件).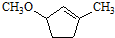 $→_{催化剂}^{H_{2}O}$…
$→_{催化剂}^{H_{2}O}$…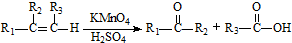 ;
;