题目内容
已知热化学方程式:2SO2(g)+O2(g)?2SO3(g)△H=-Q kJ?mol-1(Q>0).下列说法正确的是( )
| A、相同条件下,2 mol SO2(g)和1 mol O2(g)所具有的能量小于2 mol SO3(g)所具有的能量 |
| B、将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后,放出热量为Q kJ |
| C、增大压强或升高温度,该反应过程放出更多的热量 |
| D、如将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热Q kJ,则此过程中有2 mol SO2(g)被氧化 |
考点:有关反应热的计算
专题:
分析:A、该反应正反应是放热反应,反应物的总能量大于生成物的总能量;
B、反应是可逆反应,不能进行完全;
C、反应是气体体积减小的放热反应,结合温度、压强对平衡影响判断;
D、依据焓变结合热化学方程式计算判断.
B、反应是可逆反应,不能进行完全;
C、反应是气体体积减小的放热反应,结合温度、压强对平衡影响判断;
D、依据焓变结合热化学方程式计算判断.
解答:
解:A、反应是放热反应,相同条件下,2molSO2(g)和1molO2(g)所具有的能量大于2molSO3(g)所具有的能量,故A错误;
B、将2molSO2(g)和1molO2(g)置于一密闭容器中充分反应后,达到化学平衡,反应物不能全部转化,放出热量小于QkJ,故B错误;
C、反应是气体体积减小的放热反应,增大压强平衡正向进行,反应过程放出更多的热量,升高温度,该平衡向逆反应方向移动,反应过程放出更少的热量,故C错误;
D、如将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热QkJ,参加反应的二氧化硫为2mol,故一定有2molSO2(g)被氧化,故D正确;
故选D.
B、将2molSO2(g)和1molO2(g)置于一密闭容器中充分反应后,达到化学平衡,反应物不能全部转化,放出热量小于QkJ,故B错误;
C、反应是气体体积减小的放热反应,增大压强平衡正向进行,反应过程放出更多的热量,升高温度,该平衡向逆反应方向移动,反应过程放出更少的热量,故C错误;
D、如将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热QkJ,参加反应的二氧化硫为2mol,故一定有2molSO2(g)被氧化,故D正确;
故选D.
点评:本题考查了热化学方程式的应用、化学平衡的影响因素等,关键是可逆反应的焓变的意义理解.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
向CuSO4溶液中逐滴加入过量KI溶液,观察到产生白色沉淀,溶液变为棕色.淀粉KI溶液中通入SO2气体,溶液无明显变化.则下列分析中正确的是( )
| A、白色沉淀是CuI2,棕色溶液含有I2 |
| B、滴加KI溶液时,转移2mol e-时生成1mol白色沉淀 |
| C、通入SO2时,SO2与I-反应,I-作还原剂 |
| D、上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
某一红色粉末可能是Fe2O3、Cu2O其中一种或二者混合物,将粉末放入足量稀硫酸(已知Cu2O+2H+=Cu2++Cu+H2O)中,观察分析该粉末组成下列合理的是( )
| A、若固体完全溶解,则粉末中不可能有Cu2O |
| B、若固体不能完全溶解,则粉末中肯定有Cu2O |
| C、若固体完全溶解,溶液中再加KSCN,变红,则原粉末仅是Fe2O3 |
| D、若固体不能完全溶解,溶液中再加KSCN,不变红,则原粉末仅是Cu2O |
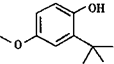
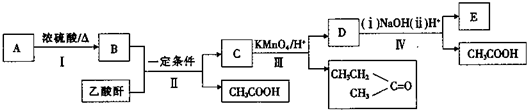
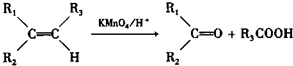
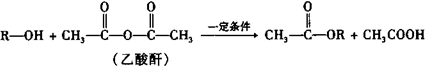
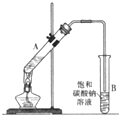 乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.
乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示. 有X、Y、Z、M、G五种元素,是分属三个短周期并且原子序数依次增大的主族元素.其中X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.完成下列填空:
有X、Y、Z、M、G五种元素,是分属三个短周期并且原子序数依次增大的主族元素.其中X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.完成下列填空: