题目内容
10g质量分数为20%的NaOH溶液与100ml质量分数为20%的NaOH溶液的浓度相比较,浓度较大的是 .
考点:物质的量浓度的相关计算
专题:
分析:溶液具有均一、稳定性,根据c=
可知,溶质都是氢氧化钠,M(NaOH)=40g/mol,质量分数相同的氢氧化钠溶液的密度相同,则两溶液的浓度一定相等.
| 1000ρω |
| M |
解答:
解:10g质量分数为20%的NaOH溶液与100mL质量分数为20%的NaOH溶液,两溶液的质量分数相等,则溶液的密度相同,
根据c=
可知,两NaOH溶液的物质的量浓度一定相等,
故答案为:两溶液浓度相等.
根据c=
| 1000ρω |
| M |
故答案为:两溶液浓度相等.
点评:本题考查了溶液的物质的量浓度与溶质质量分数的关系,题目难度不大,注意明确溶液的性质-均一性的含义,掌握好物质的量浓度与溶质质量分数的关系.

练习册系列答案
相关题目
有同学将浓硫酸与Cl2划分为一类.据此分类,下列A-D选项中能与这两种物质归为一类的是( )
| A、硝酸 | B、醋酸 |
| C、盐酸 | D、NaCl |
类推的思维方法在化学学习与研究中常会产生错误的结论,因此类推的结论最终要经过程实践的检验才能确定其正确与否.下列几种类推结论中,正确的是( )
A、由2Cu+O2
| ||||
| B、Fe3O4可表示为FeO?Fe2O3,则Pb3O4可表示为PbO?Pb2O3 | ||||
| C、过量的CO2与石灰水反应生成Ca(HCO3)2,过量CO2通入漂白粉溶液中,产物是Ca(HCO3)2和HClO | ||||
| D、CO2与过氧化钠反应只生成Na2CO3和O2故SO2与过氧化钠一定生成Na2SO3和O2 |
已知热化学方程式:2SO2(g)+O2(g)?2SO3(g)△H=-Q kJ?mol-1(Q>0).下列说法正确的是( )
| A、相同条件下,2 mol SO2(g)和1 mol O2(g)所具有的能量小于2 mol SO3(g)所具有的能量 |
| B、将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后,放出热量为Q kJ |
| C、增大压强或升高温度,该反应过程放出更多的热量 |
| D、如将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热Q kJ,则此过程中有2 mol SO2(g)被氧化 |

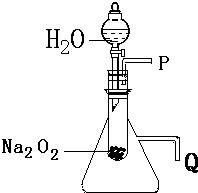 用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,向脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.
用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,向脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.