题目内容
3.两个容积均为1.12L的容器,在同温、同压下,一个盛满N2,另一个盛满CO气体,则两容器内气体的关系错误的是( )| A. | 气体分子数均为3.01×1022 | B. | 密度相等 | ||
| C. | 原子数相等 | D. | 电子数相等 |
分析 温度、压强、体积相同时,N2、CO的物质的量相同,结合N=nNA、m=nM、ρ=$\frac{m}{V}$及分子构成计算.
解答 解:温度、压强、体积相同时,N2、CO的物质的量相同,
A.状况未知,Vm不确定,则不能利用体积计算物质的量,不能利用N=nNA计算分子数,故A错误;
B.物质的量相同,M相同,质量与体积相同,可知密度相等,故B正确;
C.物质的量相同,均为双原子分子,则原子数相等,故C正确;
D.物质的量相同,1个分子均含14个电子,则电子数相等,故D正确;
故选A.
点评 本题考查阿伏伽德罗定律及应用,为高频考点,把握定律及推论的应用、物质的量的相关计算为解答的关键,侧重分析与计算能力的考查,注意物质的量相同的判断,选项A为易错点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.四种短周期元素的性质或结构信息如下表.请根据信息回答下列问题.
(1)写出元素T的离子结构示意图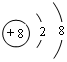 ;写出元素X的气态氢化物的电子式
;写出元素X的气态氢化物的电子式 ;写出Z元素原子的原子结构示意图:
;写出Z元素原子的原子结构示意图: ;元素Y的最高价氧化物对应水化物的电子式
;元素Y的最高价氧化物对应水化物的电子式
(2)Z单质与Y最高价氧化物的水化物的水溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑
(3)元素T与氟元素相比,非金属性较强的是F(用元素符号表示),下列表述中能证明这一事实的是bc
a.常温下氟气的颜色比T单质的颜色深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素呈正价态
d.比较两元素的单质与氢气化合时得电子的数目.
| 元素 | T | X | Y | Z |
| 性质 结构 信息 | 人体内含量最多的元素,且其单质是常见的助燃剂. | 单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼 | 单质质软、银白色固体、导电性强.单质在空气中燃烧发出黄色的火焰. | 第三周期元素的简单离子中半径最小 |
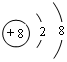 ;写出元素X的气态氢化物的电子式
;写出元素X的气态氢化物的电子式 ;写出Z元素原子的原子结构示意图:
;写出Z元素原子的原子结构示意图: ;元素Y的最高价氧化物对应水化物的电子式
;元素Y的最高价氧化物对应水化物的电子式
(2)Z单质与Y最高价氧化物的水化物的水溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑
(3)元素T与氟元素相比,非金属性较强的是F(用元素符号表示),下列表述中能证明这一事实的是bc
a.常温下氟气的颜色比T单质的颜色深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素呈正价态
d.比较两元素的单质与氢气化合时得电子的数目.
18.用NA表示阿伏伽德罗常数的值.下列判断正确的是( )
| A. | 18gH2O含有的氢分子数目为NA | |
| B. | 标准状况下,22.4LCCl4含有的分子数目为NA | |
| C. | 1L 1mol•L-1K2SO4溶液中含有的钾离子数目为NA | |
| D. | 1mol Fe与足量的稀盐酸反应,失去的电子数目为2NA |
8.下列反应的离子方程式错误的是( )
| A. | 向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| B. | 等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+NH4++HCO3-═BaCO3↓+NH3•H2O+H2O | |
| C. | 过氧化钠固体与水反应:2Na2O2+2H2O═4Na++4OH-+O2↑ | |
| D. | 向氢氧化钠溶液中通入足量的CO2气体:CO2+2OH-═CO32-+H2O |
 海水是盐的“故乡”,海水中含有各种盐类,其中70%为氯化钠,另外还含有氯化镁、硫酸镁等.
海水是盐的“故乡”,海水中含有各种盐类,其中70%为氯化钠,另外还含有氯化镁、硫酸镁等.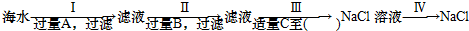
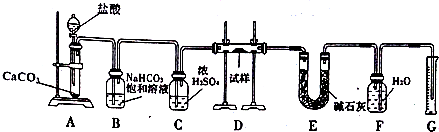
 .
.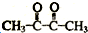 ,A→B的反应类型为氧化反应.
,A→B的反应类型为氧化反应.