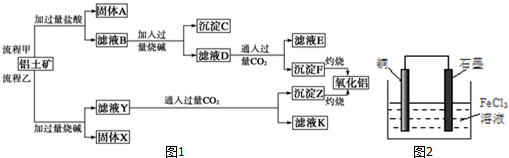
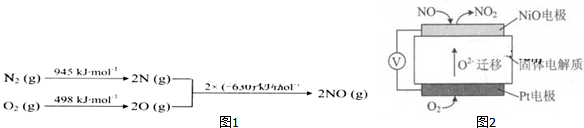题目内容
1.氯化钾溶液中混有少量的硫酸铜,若加入一种试剂能够除去硫酸铜,该试剂( )| A. | 氢氧化钠 | B. | 硝酸银 | C. | 氯化钡 | D. | 氢氧化钡 |
分析 硫酸铜与氢氧化钡反应生成硫酸钡沉淀和氢氧化铜沉淀,而KCl不反应,以此来解答.
解答 解:A.氢氧化钠与硫酸铜反应生成氢氧化铜沉淀和硫酸钠,引入新杂质硫酸钠,故A不选;
B.二者均与硝酸银反应,将KCl除去,故B不选;
C.硫酸铜与氯化钡反应生成硫酸钡沉淀和氯化铜,引入新杂质氯化铜,故C不选;
D.硫酸铜与氢氧化钡反应生成硫酸钡沉淀和氢氧化铜沉淀,而KCl不反应,则加适量氢氧化钡、过滤可除杂,故D选;
故选D.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
12.关于(CH3)3C(CH3)C=CH2的说法正确的是( )
| A. | 该物质的名称为 2,2,3-三甲基-3-丁烯 | |
| B. | 分子中最多 4 个碳原子共平面 | |
| C. | 此物质转化为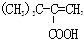 的过程中需依次经过加成、取代、氧化、消去反应 的过程中需依次经过加成、取代、氧化、消去反应 | |
| D. | 此物质与氢气加成后的产物与此物质中氢原子的种类数不同 |
9.进行化学实验必须注意安全.下列说法正确的是( )
| A. | 不能用手直接接触药品 | B. | 可用酒精灯对烧杯直接加热 | ||
| C. | 用鼻孔凑到容器口去闻气体的气味 | D. | 尝一下实验室里酒精的味道 |
16.硫酸亚铁(FeSO4)加热至高温会分解,生成一种金属氧化物M和两种非金属氧化物.某化学研究小组利用下列装置加热至高温使FeSO4分解.
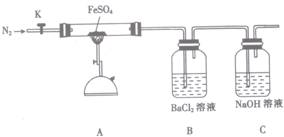
实验步骤:
将一定量FeSO4固体置于硬质玻璃管中,打开活塞K,通人一段时间N2,关闭活塞K.加热A中的玻璃管一段时间,待A中固体不再分解后,停止加热,打开K,缓慢通人氮气至玻璃管冷却.
(1)已知M中铁元素的质量分数为70%,M的化学式为Fe2O3.
(2)按图组装好仪器(已省略夹持仪器)并检查装置的气密性,在一定温度下按上述图示装置
进行实验.
(3)某同学欲验证硫酸亚铁分解产物中含有的另一种非金属氧化物N.
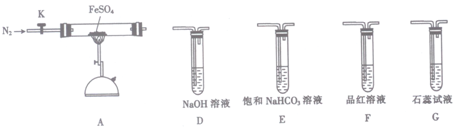
①从实验装置D、E、F、G中,选用两个装置与装置A连接进行实验,依次连接的合理顺序为A→F→D.
②能证明生成了非金属氧化物N的现象是F中品红溶液褪色.

实验步骤:
将一定量FeSO4固体置于硬质玻璃管中,打开活塞K,通人一段时间N2,关闭活塞K.加热A中的玻璃管一段时间,待A中固体不再分解后,停止加热,打开K,缓慢通人氮气至玻璃管冷却.
(1)已知M中铁元素的质量分数为70%,M的化学式为Fe2O3.
(2)按图组装好仪器(已省略夹持仪器)并检查装置的气密性,在一定温度下按上述图示装置
进行实验.
| 操作步骤 | 实验现象 | 用化学方程式解释原因 |
| 打开K,通入一段时间的N2,关闭活塞K,加热A中的玻璃管一段时间 | 洗气瓶B中①有白色沉淀生成 | ②SO3+H2O+BaCl2=BaSO4↓+2HCl |
| A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却 | 硬质玻璃管中最终可以看到③有红棕色固体物质生成 | ④2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑ |

①从实验装置D、E、F、G中,选用两个装置与装置A连接进行实验,依次连接的合理顺序为A→F→D.
②能证明生成了非金属氧化物N的现象是F中品红溶液褪色.
6.下列有关化学用语表示正确的是( )
| A. | 质子数为53、中子数为78的碘原子:${\;}_{53}^{131}$I | |
| B. | N2的电子式: | |
| C. | S2-的结构示意图: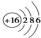 | |
| D. | 丙醛的结构简式:CH3CH2COH |
13.下列说法错误的是( )
| A. | H2O2、Na2O2都属于过氧化物,都存在共价键 | |
| B. | 双氧水是绿色氧化剂,可作医疗消毒剂 | |
| C. | H2O2既有氧化性,又有还原性,与Cl2、KMnO4反应是表现H2O2的氧化性 | |
| D. | H2O2做漂白剂是利用其氧化性,漂白原理与HClO类似,与SO2不同 |
11.下列离子组在指定溶液中能大量共存的是( )
| A. | 碱性溶液:Cu2+、Al3+、NO3-、SO42- | |
| B. | 加入KSCN显红色的溶液:K+、NH4+、Cl-、I- | |
| C. | 加入Al能放出大量H2的溶液中:NH4+、Fe2+、NO3-、SO42- | |
| D. | 常温下,c(H+)/c(OH一)=1×10-12的溶液:K+、AlO2-、CO32-、Na+ |