题目内容
A、B、X、D、E、F是周期表中的前20号元素,原子序数逐渐增大.A元素是宇宙中含量最丰富的元素,其原子的原子核内可能没有中子.A分别与B、X、D、E、F形成的分子的空间构型依次是正四面体、三角锥形、正四面体、角形(V形)、直线形.用化学式或化学符号回答下列问题:
(1)上述5种元素中,能形成酸性最强的含氧酸的元素是 ,写出该元素的常见四种含氧酸的化学式,并按酸性由强到弱的顺序 _
(2)B所在族的元素与A形成的化合物中,沸点最低的物质的结构式是 ;E所在族的元素与A形成的化合物中,沸点最低的物质的电子式是 ;
(3)一定条件下,XO2与EO2反应生成EO3和XO两种气体.将体积比为1:2的XO2、EO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 .
A、体系压强保持不变 B、混合气体颜色保持不变
C、EO2和XO的体积比保持不变 D、每消耗1mol EO2的同时生成1molXO
测得上述反应平衡时XO2与EO2体积比为1:6,则平衡常数K= .
(4)设X元素的气态氢化物为M,最高价氧化物的水化物为N,M与N反应生成一种盐Z.常温下,向pH=a的M的水溶液(设溶质的电离程度为1%)中加入等体积pH=b的N的水溶液,且a+b=14,充分作用后,该溶液中各种离子浓度由大到小的顺序为 .常温下,N、Z的水溶液pH均为4,设N、Z水溶液中由水电离出的H+浓度分别为a、b,则a比b= .
(1)上述5种元素中,能形成酸性最强的含氧酸的元素是
(2)B所在族的元素与A形成的化合物中,沸点最低的物质的结构式是
(3)一定条件下,XO2与EO2反应生成EO3和XO两种气体.将体积比为1:2的XO2、EO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
A、体系压强保持不变 B、混合气体颜色保持不变
C、EO2和XO的体积比保持不变 D、每消耗1mol EO2的同时生成1molXO
测得上述反应平衡时XO2与EO2体积比为1:6,则平衡常数K=
(4)设X元素的气态氢化物为M,最高价氧化物的水化物为N,M与N反应生成一种盐Z.常温下,向pH=a的M的水溶液(设溶质的电离程度为1%)中加入等体积pH=b的N的水溶液,且a+b=14,充分作用后,该溶液中各种离子浓度由大到小的顺序为
考点:位置结构性质的相互关系应用,化学平衡状态的判断
专题:元素周期律与元素周期表专题
分析:A、B、X、D、E、F是周期表中的前20号元素,原子序数逐渐增大.A元素是宇宙中含量最丰富的元素,其原子的原子核内可能没有中子,则A为氢元素,A分别与B、D形成的分子的空间构型都是正四面体,所以B、D都在第ⅣA族,所以B为碳,D为硅,X、E、F形成的分子的空间构型依次是三角锥形、角形(V形)、直线形,结合它们与碳、硅的原子序数关系可知,X为氮,E为硫,F为氯,据此答题;
解答:
解:A、B、X、D、E、F是周期表中的前20号元素,原子序数逐渐增大.A元素是宇宙中含量最丰富的元素,其原子的原子核内可能没有中子,则A为氢元素,A分别与B、D形成的分子的空间构型都是正四面体,所以B、D都在第ⅣA族,所以B为碳,D为硅,X、E、F形成的分子的空间构型依次是三角锥形、角形(V形)、直线形,结合它们与碳、硅的原子序数关系可知,X为氮,E为硫,F为氯,
(1)上述5种元素中,氯元素的非金属性最强,所以能形成酸性最强的含氧酸的元素是氯元素,氯元素的常见四种含氧酸的化学式为,按酸性由强到弱的顺序为HClO4>HClO3>HClO2>HClO,
故答案为:Cl;HClO4、HClO3、HClO2、HClO;
(2)在ⅣA族的元素与H形成的化合物中,沸点最低的物质为甲烷,它的结构式是 ;硫所在族的元素与H形成的化合物中,沸点最低的物质是硫化氢,它的电子式是
;硫所在族的元素与H形成的化合物中,沸点最低的物质是硫化氢,它的电子式是 ,
,
故答案为: ;
;  ;
;
(3)一定条件下,NO2与SO2反应生成SO3和NO两种气体,反应方程式为NO2+SO2?SO3+NO,
A、由于该反应气体体积不变,所以体系压强保持不变不能说明是否处于平衡状态,故错误;
B、混合气体颜色保持不变,即说明二氧化氮的浓度不变,说明反应已经处于平衡状态,故正确;
C、EO2和XO的体积比起始为1:2,反应中消耗的是1:1,所以当体积比保持不变时,说明各物质的浓度不再改变,反应处于平衡状态,故正确;
D、每消耗1mol SO2的同时生成1molNO,都是表示的正反应速率,不能说明正逆反应速率的关系,故错误;
故选BC;
设起始浓度NO2为a,则SO2为2a,反应转化的NO2为b,利用三段式分析,
NO2+SO2 ?SO3+NO
起始 a 2a
转化 b b b b
平衡 a-b 2a-b b b
根据题意有(a-b):(2a-b)=1:6,所以a=1.25b,则平衡常数K=
=
=2.67,
故答案为:BC;2.67;
(4)M为氨气,N为硝酸,Z为硝酸铵,常温下,向pH=a的氨气的水溶液(设溶质的电离程度为1%)中加入等体积pH=b的硝酸溶液,且a+b=14,则说明氨水中已经电离出来的氢氧根离子与硝酸电离产生的氢离子恰好完全反应,而在混合溶液中氨水过量较多,溶液呈碱性,所以该溶液中各种离子浓度由大到小的顺序为NH4+>NO3->OH->H+,
常温下,N、Z的水溶液pH均为4,硝酸铵水解促进水的电离,b=10-4 mol/L,硝酸抑制水的电离,a=c(OH-)=
=10-10 mol/L,所以a:b=10-10:10-4=10-6,
故答案为:NH4+>NO3->OH->H+;10-6 .
(1)上述5种元素中,氯元素的非金属性最强,所以能形成酸性最强的含氧酸的元素是氯元素,氯元素的常见四种含氧酸的化学式为,按酸性由强到弱的顺序为HClO4>HClO3>HClO2>HClO,
故答案为:Cl;HClO4、HClO3、HClO2、HClO;
(2)在ⅣA族的元素与H形成的化合物中,沸点最低的物质为甲烷,它的结构式是
 ;硫所在族的元素与H形成的化合物中,沸点最低的物质是硫化氢,它的电子式是
;硫所在族的元素与H形成的化合物中,沸点最低的物质是硫化氢,它的电子式是 ,
,故答案为:
 ;
;  ;
;(3)一定条件下,NO2与SO2反应生成SO3和NO两种气体,反应方程式为NO2+SO2?SO3+NO,
A、由于该反应气体体积不变,所以体系压强保持不变不能说明是否处于平衡状态,故错误;
B、混合气体颜色保持不变,即说明二氧化氮的浓度不变,说明反应已经处于平衡状态,故正确;
C、EO2和XO的体积比起始为1:2,反应中消耗的是1:1,所以当体积比保持不变时,说明各物质的浓度不再改变,反应处于平衡状态,故正确;
D、每消耗1mol SO2的同时生成1molNO,都是表示的正反应速率,不能说明正逆反应速率的关系,故错误;
故选BC;
设起始浓度NO2为a,则SO2为2a,反应转化的NO2为b,利用三段式分析,
NO2+SO2 ?SO3+NO
起始 a 2a
转化 b b b b
平衡 a-b 2a-b b b
根据题意有(a-b):(2a-b)=1:6,所以a=1.25b,则平衡常数K=
| b2 |
| (a-b)(2a-b) |
| 8 |
| 3 |
故答案为:BC;2.67;
(4)M为氨气,N为硝酸,Z为硝酸铵,常温下,向pH=a的氨气的水溶液(设溶质的电离程度为1%)中加入等体积pH=b的硝酸溶液,且a+b=14,则说明氨水中已经电离出来的氢氧根离子与硝酸电离产生的氢离子恰好完全反应,而在混合溶液中氨水过量较多,溶液呈碱性,所以该溶液中各种离子浓度由大到小的顺序为NH4+>NO3->OH->H+,
常温下,N、Z的水溶液pH均为4,硝酸铵水解促进水的电离,b=10-4 mol/L,硝酸抑制水的电离,a=c(OH-)=
| 10-14 |
| 10-4 |
故答案为:NH4+>NO3->OH->H+;10-6 .
点评:本题主要考查了结构式、电子式、元素周期律、平衡常数的计算、平衡状态的判断、pH的计算等知识点,难度较大,涉及的知识点较多,元素推断是解题的前提,溶液计算是本题的难点.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
下列过程或事实不涉及氧化还原反应的是( )
①蔗糖炭化
②用氢氟酸雕刻玻璃
③铁遇冷的浓硫酸钝化
④装碱液的试剂瓶不用玻璃塞
⑤雷雨发庄稼
⑥浓硝酸常显黄色.
①蔗糖炭化
②用氢氟酸雕刻玻璃
③铁遇冷的浓硫酸钝化
④装碱液的试剂瓶不用玻璃塞
⑤雷雨发庄稼
⑥浓硝酸常显黄色.
| A、①③⑤⑥ | B、②④ |
| C、②④⑥ | D、①②③④⑤⑥ |
下列关于工业生产说法正确的是 ( )
| A、在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气 |
| B、在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率 |
| C、在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室 |
| D、工业上采用电解熔融氯化铝的方法制取金属铝 |
| E、石油裂化属于化学变化,主要目的是为了获得短链不饱和气态烃 |
已知:①卤代烃在一定条件下可发生水解反应生成醇.②醇可被强氧化剂氧化生成羧酸.CH2BrCH=CHCH2Br可经三步反应制取HOOCCH(Cl)CH2COOH,发生反应的类型依次是( )
| A、水解反应、加成反应、氧化反应 |
| B、加成反应、水解反应、氧化反应 |
| C、水解反应、氧化反应、加成反应 |
| D、加成反应、氧化反应、水解反应 |
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.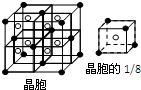 A、B、C、D、E是周期表中原子序数依次增大的前20号主族元素,其中A、D同族. A是周期表中电负性最大的元素,金属元素B、C最高价氧化物对应的水化物能反应生成盐和水,E元素以骨盐形式存在于骨骼和牙齿中.根据信息,回答下列问题:
A、B、C、D、E是周期表中原子序数依次增大的前20号主族元素,其中A、D同族. A是周期表中电负性最大的元素,金属元素B、C最高价氧化物对应的水化物能反应生成盐和水,E元素以骨盐形式存在于骨骼和牙齿中.根据信息,回答下列问题: