题目内容
已知A是一种常见金属,C是强碱,有以下物质相互转化.
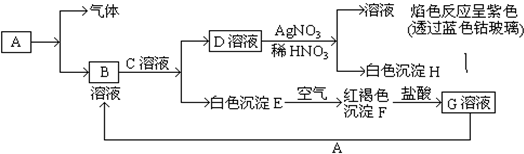
(1)A转化成B及气体这步反应中应加入的试剂是 ;
(2)写出B的化学式 ,D的化学式 ;
(3)写出由E转变成F的化学方程式 ,写出鉴别G溶液的离子方程式 ;向G溶液中加入A的有关离子方程式是 .

(1)A转化成B及气体这步反应中应加入的试剂是
(2)写出B的化学式
(3)写出由E转变成F的化学方程式
考点:无机物的推断
专题:
分析:白色沉淀E在空气中变化为红褐色沉淀F,说明E为Fe(OH)2,F为Fe(OH)3,F与盐酸反应生成G为FeCl3,金属A与氯化铁反应生成B,B与碱C反应得到E与D,故A为Fe,B为FeCl2,则Fe与元素反应生成氢气与氯化亚铁.D溶液和硝酸酸化的硝酸银反应生成白色沉淀H为AgCl,溶液透过钴玻璃进行焰色反应为紫色,证明溶液中含有钾元素,故D为KCl,则C为KOH,据此解答.
解答:
解:白色沉淀E在空气中变化为红褐色沉淀F,说明E为Fe(OH)2,F为Fe(OH)3,F与盐酸反应生成G为FeCl3,金属A与氯化铁反应生成B,B与碱C反应得到E与D,故A为Fe,B为FeCl2,则Fe与元素反应生成氢气与氯化亚铁.D溶液和硝酸酸化的硝酸银反应生成白色沉淀H为AgCl,溶液透过钴玻璃进行焰色反应为紫色,证明溶液中含有钾元素,故D为KCl,则C为KOH,
(1)A转化成B及气体是Fe与盐酸反应生成氯化亚铁与氢气,故答案为:盐酸;
(2)由上述分析可知,B的化学式为FeCl2,D的化学式为KCl,故答案为:FeCl2;KCl;
(3)由E转变成F是氢氧化亚铁被氧化为氢氧化铁,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
用KSCN鉴别G(FeCl3)溶液中三价铁离子,反应的离子方程式为:Fe3++3SCN-=Fe(SCN)3;
向G溶液中加入Fe的有关离子方程式是:Fe+2Fe 3+=3Fe2+,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;Fe3++3SCN-=Fe(SCN)3;Fe+2Fe 3+=3Fe2+.
(1)A转化成B及气体是Fe与盐酸反应生成氯化亚铁与氢气,故答案为:盐酸;
(2)由上述分析可知,B的化学式为FeCl2,D的化学式为KCl,故答案为:FeCl2;KCl;
(3)由E转变成F是氢氧化亚铁被氧化为氢氧化铁,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
用KSCN鉴别G(FeCl3)溶液中三价铁离子,反应的离子方程式为:Fe3++3SCN-=Fe(SCN)3;
向G溶液中加入Fe的有关离子方程式是:Fe+2Fe 3+=3Fe2+,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;Fe3++3SCN-=Fe(SCN)3;Fe+2Fe 3+=3Fe2+.
点评:本题以无机框图题的形式,考查Fe、Cl等元素单质及其化合物之间的相互转化关系,本题中白色沉淀转化为红褐色沉淀,溶液K焰色反应为紫色等解题突破口,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
1 1 |
2 1 |
3 1 |
| A、氢的五种同位素 |
| B、五种氢元素 |
| C、氢的五种原子 |
| D、氢元素的五种不同微粒 |
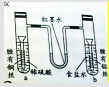 某同学为了探究金属腐蚀的原理,设计了如图装置,U型管内为红墨水,a、b试管内分别盛有稀硫酸和NaCl溶液,然后分别浸入末端缠有铜丝和铝丝的铁钉,放置一段时间,下列有关描述错误的是( )
某同学为了探究金属腐蚀的原理,设计了如图装置,U型管内为红墨水,a、b试管内分别盛有稀硫酸和NaCl溶液,然后分别浸入末端缠有铜丝和铝丝的铁钉,放置一段时间,下列有关描述错误的是( )| A、a、b中负极反应式均是:Fe-2e═Fe2+ |
| B、红墨水柱两边的液面变为左低右高 |
| C、a中铁钉上发生了氧化反应,b中铁钉上发生还原反应 |
| D、a中铜丝附近有气泡产生,b中有白色沉淀产生 |
下列说法正确的是( )
| A、电解质在水中一定能导电 |
| B、纯水的导电性很差,所以水不是电解质 |
| C、溶液导电性的强弱取决于溶液中离子浓度及所带电荷的多少 |
| D、NaCl溶液在电流作用下电离成Na+与Cl- |
只用水就能鉴别的一组物质是( )
| A、苯酚、乙醇、甘油 |
| B、乙醇、己烯、苯磺酸 |
| C、乙醛、乙二醇、硝基苯 |
| D、苯、乙醇、四氯化碳 |



