题目内容
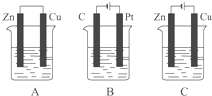 如图所示,A、B、C三个装置的烧杯中分别盛有足量的CuCl2溶液.按要求写出电极反应式.A池中铜电极上的电极反应式为:
如图所示,A、B、C三个装置的烧杯中分别盛有足量的CuCl2溶液.按要求写出电极反应式.A池中铜电极上的电极反应式为:考点:原电池和电解池的工作原理
专题:电化学专题
分析:A装置是原电池,较活泼的金属锌作负极,较不活泼的金属铜作正极;B为电解池,Pt作阳极,C为阴极,阳极上氯离子失电子;C为电解池,Cu为阳极,Zn为阴极,阴极上铜离子得电子.
解答:
解:A装置是原电池,较活泼的金属锌作负极,较不活泼的金属铜作正极,正极上铜离子得电子,则正极反应式为:Cu2++2e-=Cu;
B为电解池,Pt作阳极,C为阴极,阳极上氯离子失电子,则Pt上电极反应式为:2Cl--2e-=Cl2↑;
C为电解池,Cu为阳极,Zn为阴极,Zn极上铜离子得电子,则其电极反应式为:Cu2++2e-=Cu.
故答案为:Cu2++2e-=Cu;2Cl--2e-=Cl2↑;Cu2++2e-=Cu.
B为电解池,Pt作阳极,C为阴极,阳极上氯离子失电子,则Pt上电极反应式为:2Cl--2e-=Cl2↑;
C为电解池,Cu为阳极,Zn为阴极,Zn极上铜离子得电子,则其电极反应式为:Cu2++2e-=Cu.
故答案为:Cu2++2e-=Cu;2Cl--2e-=Cl2↑;Cu2++2e-=Cu.
点评:本题考查了原电池和电解池原理的简单应用,注意活泼金属作电解池阳极时,阳极上电极材料放电而不是溶液中阴离子放电,注意把握电极方程式的书写方法,题目难度不大.

练习册系列答案
相关题目
一定温度时,向2.0L恒容密闭容器中充入2mol SO2和1mol O2,发生反应:
2SO2(g)+O2(g)?2SO3(g).经过一段时间后达到平衡.反应过程中测定的部分数据见下表:
下列说法正确的是( )
2SO2(g)+O2(g)?2SO3(g).经过一段时间后达到平衡.反应过程中测定的部分数据见下表:
| t/s | 0 | t1 | t2 | t3 | t4 |
| n(SO3)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
A、反应在前t1 s 的平均速率v(O2)=
| ||
| B、保持其他条件不变,体积压缩到1.0L,平衡常数将增大 | ||
| C、相同温度下,起始时向容器中充入4mol SO3,达到平衡时,SO3的转化率大于10% | ||
D、保持温度不变,向该容器中再充入2mol SO2、1mol O2,反应达到新平衡时
|
下列各组物质不属于同分异构体的是( )
| A、2,2-二甲基丙醇和2-甲基丁醇 |
| B、邻氯甲苯和对氯甲苯 |
| C、2-甲基丁烷和戊烷 |
| D、乙醇和丙醇 |