题目内容
在FeCl3溶液蚀刻铜箔制造电路板的工艺中,反应后废液处理和资源回收的过程如下:
①向废液中投入过量铁屑,充分反应后分离出固体和滤液;
②向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气.
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为 ,
(2)过程①加入铁屑的主要作用是 ,分离得到固体的主要成分是 .
①向废液中投入过量铁屑,充分反应后分离出固体和滤液;
②向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气.
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为
(2)过程①加入铁屑的主要作用是
考点:铁的氧化物和氢氧化物
专题:元素及其化合物
分析:(1)三价铁离子具有强的氧化性,能够氧化铜单质生成铜离子,本身被还原为二价铁离子;
(2)过程①加入铁屑的主要作用是和氯化铜发生反应生成铜,过滤后得到固体为Fe和Cu.
(2)过程①加入铁屑的主要作用是和氯化铜发生反应生成铜,过滤后得到固体为Fe和Cu.
解答:
解:(1)氯化铁与铜反应生成氯化亚铁和氯化铜,反应的离子方程式:2Fe3++Cu=2Fe2++Cu2+;
故答案为:2Fe3++Cu=2Fe2++Cu2+;
(2)向废液中投入过量铁屑,铁会和三氯化铁溶液反应生成氯化亚铁,和氯化铜反应生成铜和氯化亚铁,所以加入铁粉是为了得到铜,过滤得到固体是过量的铁和铜;
故答案为:回收铜;Cu和Fe.
故答案为:2Fe3++Cu=2Fe2++Cu2+;
(2)向废液中投入过量铁屑,铁会和三氯化铁溶液反应生成氯化亚铁,和氯化铜反应生成铜和氯化亚铁,所以加入铁粉是为了得到铜,过滤得到固体是过量的铁和铜;
故答案为:回收铜;Cu和Fe.
点评:本题考查了铁离子的氧化性,提取铜的反应过程,不同价态铁元素之间的转化和二价铁离子、三价铁离子的检验是高考的热点,熟悉两种离子的性质是解题关键.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
下列说法正确的是( )
| A、c( H+)>c(OH-)的溶液一定显酸性 |
| B、常温下,pH=6 的溶液一定是酸溶液 |
| C、电解稀硫酸或氢氧化钠溶液的产物不同 |
| D、将纯水加热,其KW增大而pH不变 |
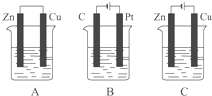 如图所示,A、B、C三个装置的烧杯中分别盛有足量的CuCl2溶液.按要求写出电极反应式.A池中铜电极上的电极反应式为:
如图所示,A、B、C三个装置的烧杯中分别盛有足量的CuCl2溶液.按要求写出电极反应式.A池中铜电极上的电极反应式为: