题目内容
硅是重要的半导体材料,构成现代电子工业的基础.请回答下列问题:
(1)硅原子中能量最高的电子处在 电子层上(填写电子层符号),该层电子占有的原子轨道数为 .
(2)单质硅存在与金刚石结构类似的晶体,其中硅原子之间以 相结合(选填编号).14克单晶硅中存在 个Si-Si键.
a.极性键 b.非极性键 c.离子键 d.范德华力
(3)写出SiH4在氧气中燃烧的化学方程式: ;
(4)SiH4的热稳定性不如CH4,其原因是 .
工业上硅铁可以用于冶镁.以煅白(CaO?MgO)为原料与硅铁(含硅75%的硅铁合金)混合,置于密闭设备中于1200℃发生反应:2(CaO?MgO)(s)+Si(s)?Ca2SiO4 (l)+2Mg(g)
(5)常温下镁的还原性强于硅.上述方法能够获得镁的原因是 .
(6)若上述反应在容积为a L的密闭容器中发生,一定能说明反应已达平衡的是 (选填编号).
a.反应物不再转化为生成物 b.炉内Ca2SiO4与CaO?MgO的质量比保持不变
c.反应放出的热量不再改变 d.单位时间内,n(CaO?MgO)消耗:n(Ca2SiO4)生成=2:1
若b g煅白经t min反应后转化率达50%,该时段内Mg的生成速率是 .
(1)硅原子中能量最高的电子处在
(2)单质硅存在与金刚石结构类似的晶体,其中硅原子之间以
a.极性键 b.非极性键 c.离子键 d.范德华力
(3)写出SiH4在氧气中燃烧的化学方程式:
(4)SiH4的热稳定性不如CH4,其原因是
工业上硅铁可以用于冶镁.以煅白(CaO?MgO)为原料与硅铁(含硅75%的硅铁合金)混合,置于密闭设备中于1200℃发生反应:2(CaO?MgO)(s)+Si(s)?Ca2SiO4 (l)+2Mg(g)
(5)常温下镁的还原性强于硅.上述方法能够获得镁的原因是
(6)若上述反应在容积为a L的密闭容器中发生,一定能说明反应已达平衡的是
a.反应物不再转化为生成物 b.炉内Ca2SiO4与CaO?MgO的质量比保持不变
c.反应放出的热量不再改变 d.单位时间内,n(CaO?MgO)消耗:n(Ca2SiO4)生成=2:1
若b g煅白经t min反应后转化率达50%,该时段内Mg的生成速率是
考点:硅和二氧化硅,化学平衡状态的判断
专题:碳族元素
分析:(1)原子中,离原子核越远的电子层其能量越高;该原子中含有3个s轨道、6个p轨道;
(2)硅晶体和金刚石晶体类似都属于原子晶体,硅原子之间以共价键结合,单质硅是正四面体结构;
(3)SiH4在氧气中燃烧生成二氧化硅和水;
(4)根据元素周期律知识:同主族从上到下,氢化物的稳定性逐渐减弱来回答;
(5)根据化学平衡移动原理来回答;
(6)根据化学平衡状态的特征分析,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、质量、体积分数以及百分含量不变,以及由此衍生的一些量也不发生变化;一定条件下若反应达到最大限度,说明达到了平衡状态;根据v=
来计算化学反应速率.
(2)硅晶体和金刚石晶体类似都属于原子晶体,硅原子之间以共价键结合,单质硅是正四面体结构;
(3)SiH4在氧气中燃烧生成二氧化硅和水;
(4)根据元素周期律知识:同主族从上到下,氢化物的稳定性逐渐减弱来回答;
(5)根据化学平衡移动原理来回答;
(6)根据化学平衡状态的特征分析,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、质量、体积分数以及百分含量不变,以及由此衍生的一些量也不发生变化;一定条件下若反应达到最大限度,说明达到了平衡状态;根据v=
| △c |
| △t |
解答:
解:(1)原子中,离原子核越远的电子层其能量越高,所以Si原子中M电子层能量最高;该原子中含有3个s轨道、6个p轨道,一共有9个轨道,M层电子占有的原子轨道数为3,故答案为:M;3;
(2)硅晶体和金刚石晶体类似都属于原子晶体,硅原子之间以非极性共价键结合,单质硅是正四面体结构,14克单晶硅中存在Si-Si键的数目是
×2NA=NA,故答案为:b; NA;
(3)SiH4在氧气中燃烧生成二氧化硅和水,方程式为:SiH4+O2
SiO2+2H2O,故答案为:SiH4+O2
SiO2+2H2O;
(4)根据元素周期律,非金属性C>Si,则它们的气态氢化物的热稳定性CH4>SiH4,
故答案为:非金属性C>Si,它们的气态氢化物的热稳定性CH4>SiH4;
(5)1200℃时发生反应为2(CaO?MgO)(s)+Si(s)?Ca2SiO4 (l)+2Mg(g),此时镁以蒸气的形式逸出,使平衡向正反应方向移动,使得化学反应能发生,故答案为:1200℃时反应生成的镁以蒸气的形式逸出,使平衡向正反应方向移动;
(6)a.化学平衡是动态平衡,反应物不再转化为生成物,则是证明反应结束的,故错误;
b.炉内Ca2SiO4与CaO?MgO的质量比保持不变,达到了平衡,故正确;
c.反应放出的热量不再改变,证明正逆反应速率是相等的,各个组分的浓度不随时间的变化而改变,故正确;
d.单位时间内,n(CaO?MgO)消耗:n(Ca2SiO4)生成=2:1,不能证明正逆反应速率相等,故错误.
Mg的生成速率v=
=
mol/(L?min),
故答案为:bc;
mol/(L?min).
(2)硅晶体和金刚石晶体类似都属于原子晶体,硅原子之间以非极性共价键结合,单质硅是正四面体结构,14克单晶硅中存在Si-Si键的数目是
| 14g |
| 28g/mol |
(3)SiH4在氧气中燃烧生成二氧化硅和水,方程式为:SiH4+O2
| ||
| ||
(4)根据元素周期律,非金属性C>Si,则它们的气态氢化物的热稳定性CH4>SiH4,
故答案为:非金属性C>Si,它们的气态氢化物的热稳定性CH4>SiH4;
(5)1200℃时发生反应为2(CaO?MgO)(s)+Si(s)?Ca2SiO4 (l)+2Mg(g),此时镁以蒸气的形式逸出,使平衡向正反应方向移动,使得化学反应能发生,故答案为:1200℃时反应生成的镁以蒸气的形式逸出,使平衡向正反应方向移动;
(6)a.化学平衡是动态平衡,反应物不再转化为生成物,则是证明反应结束的,故错误;
b.炉内Ca2SiO4与CaO?MgO的质量比保持不变,达到了平衡,故正确;
c.反应放出的热量不再改变,证明正逆反应速率是相等的,各个组分的浓度不随时间的变化而改变,故正确;
d.单位时间内,n(CaO?MgO)消耗:n(Ca2SiO4)生成=2:1,不能证明正逆反应速率相等,故错误.
Mg的生成速率v=
| ||||
| at |
| 0.5b |
| 96at |
故答案为:bc;
| 0.5b |
| 96at |
点评:本题目综合考查学学生物质的结构和化学键、化学反应速率的计算、化学平衡状态的判断以及元素周期律知识,是一道知识的灵活应用题目,注意能力的培养是关键,难度大.

练习册系列答案
相关题目
下列各反应对应的离子方程式正确的是( )
| A、次氯酸钠溶液中通入过量二氧化硫ClO-+H2O+SO2→HClO+HSO3- |
| B、向碳酸氢钠溶液中加入过量氢氧化钙溶液2HCO3-+Ca2++2OH-→CaCO3↓+2H2O+CO32- |
| C、氢氧化钡溶液与硫酸溶液反应得到中性溶液Ba2++OH-+H++SO42-→BaSO4↓+H2O |
| D、50 mL 1mol/L的NaOH溶液中通入0.03mol H2S:5OH-+3H2S→HS-+2S2-+5H2O |
下列各图示实验设计和操作合理的是( )
A、 证明非金属性强弱:S>C>Si |
B、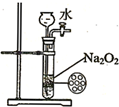 制备少量氧气 |
C、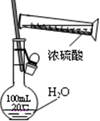 配制一定物质的量浓度的硫酸溶液 |
D、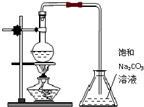 制备少量乙酸丁酯 |
常温下某H2CO3溶液的pH约为5.5,c(CO32-)约为5×10-11mol/L,该溶液中浓度最低的离子是( )
| A、HCO3- |
| B、CO32- |
| C、H+ |
| D、OH- |

 (或写成
(或写成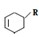 R代表取代基或氢);Ⅱ.甲为烃;Ⅲ.F能与NaHCO3反应产生CO2;请完成以下问题:
R代表取代基或氢);Ⅱ.甲为烃;Ⅲ.F能与NaHCO3反应产生CO2;请完成以下问题:
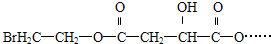
 )的原料,试写出其结构简式
)的原料,试写出其结构简式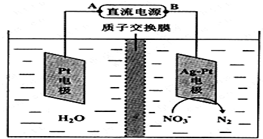 化学在环境保护中起着十分重要的作用,电化学降解法可用于治理酸性水中的硝酸盐污染.电化学降解NO3-的原理如图所示.
化学在环境保护中起着十分重要的作用,电化学降解法可用于治理酸性水中的硝酸盐污染.电化学降解NO3-的原理如图所示.