题目内容
下列各反应对应的离子方程式正确的是( )
| A、次氯酸钠溶液中通入过量二氧化硫ClO-+H2O+SO2→HClO+HSO3- |
| B、向碳酸氢钠溶液中加入过量氢氧化钙溶液2HCO3-+Ca2++2OH-→CaCO3↓+2H2O+CO32- |
| C、氢氧化钡溶液与硫酸溶液反应得到中性溶液Ba2++OH-+H++SO42-→BaSO4↓+H2O |
| D、50 mL 1mol/L的NaOH溶液中通入0.03mol H2S:5OH-+3H2S→HS-+2S2-+5H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.次氯酸根和过量二氧化硫反应生成氯离子、硫酸根离子;
B.向碳酸氢钠溶液中加入过量氢氧化钙溶液,二者反应生成碳酸钙、氢氧化钠和水;
C.氢氧根离子、氢离子和水分子的计量数都是2;
D.n(NaOH)=1mol/L×0.05L=0.05mol,50 mL 1mol/L的NaOH溶液中通入0.03mol H2S,设硫化钠的物质的量是x,硫氢化钠的物质的量是y,根据钠原子和硫原子守恒得,
解得
,所以硫化钠和硫氢化钠的物质的量之比是2:1.
B.向碳酸氢钠溶液中加入过量氢氧化钙溶液,二者反应生成碳酸钙、氢氧化钠和水;
C.氢氧根离子、氢离子和水分子的计量数都是2;
D.n(NaOH)=1mol/L×0.05L=0.05mol,50 mL 1mol/L的NaOH溶液中通入0.03mol H2S,设硫化钠的物质的量是x,硫氢化钠的物质的量是y,根据钠原子和硫原子守恒得,
|
|
解答:
解:A.次氯酸根和过量二氧化硫反应生成氯离子、硫酸根离子,离子方程式为ClO-+H2O+SO2=Cl-+SO42-+2H+,故A错误;
B.向碳酸氢钠溶液中加入过量氢氧化钙溶液,二者反应生成碳酸钙、氢氧化钠和水,离子方程式为HCO3-+Ca2++OH-=CaCO3↓+H2O,故B错误;
C.氢氧根离子、氢离子和水分子的计量数都是2,离子方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故C错误;
D.n(NaOH)=1mol/L×0.05L=0.05mol,50 mL 1mol/L的NaOH溶液中通入0.03mol H2S,设硫化钠的物质的量是x,硫氢化钠的物质的量是y,根据钠原子和硫原子守恒得,
解得
,所以硫化钠和硫氢化钠的物质的量之比是2:1,离子方程式为5OH-+3H2S=HS-+2S2-+5H2O,故D正确;
故选D.
B.向碳酸氢钠溶液中加入过量氢氧化钙溶液,二者反应生成碳酸钙、氢氧化钠和水,离子方程式为HCO3-+Ca2++OH-=CaCO3↓+H2O,故B错误;
C.氢氧根离子、氢离子和水分子的计量数都是2,离子方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故C错误;
D.n(NaOH)=1mol/L×0.05L=0.05mol,50 mL 1mol/L的NaOH溶液中通入0.03mol H2S,设硫化钠的物质的量是x,硫氢化钠的物质的量是y,根据钠原子和硫原子守恒得,
|
|
故选D.
点评:本题考查了离子方程式的书写,明确离子之间发生反应实质是解本题关键,再结合离子反应方程式书写规则分析,易错选项是D,要结合原子守恒确定生成物,再根据原子守恒书写离子方程式,难度中等.

练习册系列答案
相关题目
下列有关同分异构体数目的叙述不正确的是( )
| A、若甲苯苯环上的一个氢原子被一个含3个碳原子的烷基取代,所得产物有6种 |
B、与 互为同分异构体的芳香族化合物有6种 互为同分异构体的芳香族化合物有6种 |
| C、含有5个碳原子的饱和链烃,其一氯取代物共有8种 |
D、菲的结构简式为 ,它与硝酸反应,可生成5种一硝基取代物 ,它与硝酸反应,可生成5种一硝基取代物 |
已知氧化性:HClO>Cl2>Fe3+>SO42-;常温下,电离常数:K(H2CO3)>K(HClO)>K(HCO3-)>KAl(OH)3;则下列相关离子方程式正确的是( )
| A、0.5mol/L的NaHSO3溶液与1.0mol/L的NaClO溶液等体积混合:HSO3-+ClO-═SO42-+Cl-+H+ |
| B、小苏打溶液与偏铝酸钠溶液混合:HCO3-+AlO2-+H2O═Al(OH)3↓+CO32- |
| C、“84”消毒液(主要成分为NaClO)露置在空气中变质:2ClO-+CO2+H2O═CO32-+2HClO |
| D、在“84”消毒液中滴加FeSO4溶液:2Fe2++ClO-+H2O═2Fe3++Cl-+2OH- |
如图实验装置或操作能达到目的是( )
A、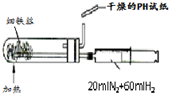 合成氨并检验氨的生成 |
B、 碘的CCl4溶液中分离I2并回收CCl4 |
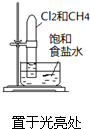
C、 分离CH3CH2OH和CH3COOC2H5混合液 |
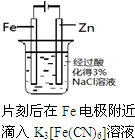
D、 制备Fe(OH)2 |
下列有关化学用语的说法中不正确的是( )
A、-OH与 都表示羟基 都表示羟基 |
B、聚丙烯的结构简式: |
C、CH4分子的球棍模型: |
D、次氯酸分子的电子式: |
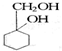 的流程图:
的流程图: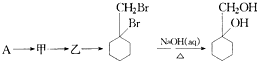
 有多种同分异构体,写出同时符合下列4个条件它的同分异构体的结构简式:
有多种同分异构体,写出同时符合下列4个条件它的同分异构体的结构简式: